
O presente trabalho é uma ampla revisão bibliográfica realizada com o objetivo de abordar os vários aspectos envolvidos nos banhos de níquel tipo Watts. Ele será publicado na forma de vários artigos cada qual tratando de um aspecto específico. Esta primeira parte tratará da função dos principais constituintes, é uma REPUBLICAÇÃO DA MATÉRIA TÉCNICA PUBLICADA NA REVISTA TRATAMENTO DE SUPERFÍCIE, EDIÇÃO 74, PÁGINAS 32 a 38, NOVEMBRO/DEZEMBRO DE 1995
1. INTRODUÇÃO
A eletrodeposição de níquel começou em 1843, quando R. Botger descreveu um processo que utilizava sulfatos duplos de amônio e níquel. No entanto, a aplicação em escala comercial só começou em 1869, em Boston. Nessa época, já se constatou a grande importância da pureza do banho o que exigia a utilização de sais de alta pureza. Os anodos de níquel também eram uma preocupação, necessitando-se o uso de anodos puros. Foi introduzido o ácido bórico como tamponante e sais de cloreto para promover a corrosão dos anodos. No começo do século, a eletrodeposição de níquel alcançou rápida popularidade, sendo este revestimento reconhecido como símbolo de luxo e eficiência, tanto é que uma estrada de ferro americana chegou a ser designada de Níquel Plating Road, por ser uma estrada de ferro luxuosa e supereficiente. Hoje em dia, é um dos processos que apresenta maior diversificação. Existem banhos de níquel brilhante, semibrilhante, fosco, banhos de deposição rápida, banhos para obtenção de camadas dúteis, com baixas tensões ou de alta dureza, banhos destinados à eletroformação e outros.
Um dos marcos importantes da história da eletrodeposição de níquel foi a introdução dos banhos de deposição rápida por O.P. Watts, banhos estes que continham sulfato de níquel, cloreto de níquel e ácido bórico. Esse tipo de banho passou a ser conhecido como banho de níquel tipo Watts. Os banhos modernos tipo Watts são mais concentrados do que aquele concebido inicialmente, apresentando a composição dentro das seguintes faixas:
Sulfato de níquel (NiSO4.6H2O) ------------- (240 a 300) g/L
Cloreto de níquel (NiCl2.6H2O) -------------- (40 a 60) g/L
Ácido bórico (H3BO3) ----------------------- 25 a 40) g/L
pH ----------------------------------------- 1,5 a 4,5
2. FUNÇÃO DO SULFATO DE NÍQUEL
O sulfato de níquel pode ser comercializado tanto como sal hepta-hidratado (NiSO4.7H2O), como hexa-hidratado (NiSO4.6H2O). A quantidade de íons de níquel contida em cada um desses sais é a seguinte:
1 g de (NiSO4.7H2O) contém 0,209 g de Ni2+
1 g de (NiSO4.6H2O) contém 0,223 g de Ni2+
O sulfato de níquel é obtido comercialmente com alta pureza, é mais barato do que o cloreto de níquel, sua corrosividade em relação aos componentes metálicos utilizados nos processo (gancheiras, garras para contatos elétricos) é menor do que a do cloreto de níquel, não é volátil, possui alta solubilidade (570 g/L a 50 °C) e os íons sulfato são estáveis nas condições operacionais dos banhos de níquel.
Devido às propriedades acima citadas, o sulfato de níquel é utilizado como a principal fonte de íons de níquel nos banhos.
3. FUNÇÃO DO CLORETO DE NÍQUEL
O cloreto de níquel é comercializado como sal hexa-hidratado (NiCl2.6H2O). A quantidade de íons de níquel contidos neste sal é a seguinte:
1 g de NiCl2.6H2O contém 0,247 g de Ni2+
As funções do cloreto de níquel são as seguintes:
- dissolução do anodo: esta é uma das principais funções do cloreto, nos processos em que se utiliza anodos eletrolíticos normais. Na ausência de cloreto no banho, os anodos de níquel eletrolítico passivam-se funcionando como anodos inertes. Na presença de cloretos, o níquel corrói pelo mecanismo de corrosão por pite, e os anodos de níquel passam a funcionar como anodos solúveis. A quantidade de íons cloreto necessária para uma boa dissolução dos anodos depende dos outros parâmetros do processo, principalmente do pH e da composição dos anodos. Como regra geral, considera-se a concentração mínima de 15 g/L de íons cloreto (50 g/L de NiCl2.6H2O) como sendo suficiente para uma boa dissolução dos anodos. Concentrações maiores não melhoram significativamente a dissolução dos anodos;
- melhoria da uniformidade macroscópica do revestimento (poder de penetração): mesmo em componentes de geometria simples, como chapas, existe uma diferença de espessura da camada de níquel eletrodepositada entre as bordas e o centro da chapa. Isto ocorre, porque os banhos ácidos de sais simples, como os banhos de níquel tipo Watts, possuem baixo poder de penetração. A presença de cloretos melhora sensivelmente o poder de penetração dos banhos de níquel. Para se ter uma ideia é apresentada a Figura 1, referente a um banho com 310 g/L de sulfato de níquel, 40 g/L de ácido bórico, pH = 3,7 e temperatura de 55 ° A curva 1 refere-se a um banho com adição de 15 g/L de íons cloreto (50 g/L de NiCl2.6H2O) e a curva 2 a um banho com 50 g/L de íons cloreto (168 g/L de NiCl2.6H2O). Pode-se verificar que a diferença de espessura entre a zona de alta densidade de corrente (borda da chapa) e a de baixa densidade de corrente (centro da chapa) é de 12,5 mm para o banho com 168 g/L de NiCl2.6H2O. Essa diferença aumenta para 17,5 mm para o banho de 50 g/L de NiCl2.6H2O. Assim sendo, quanto maior a concentração de cloreto de níquel maior será a uniformidade da camada de níquel em termos de espessura, em outras palavras melhor será o poder de penetração do banho;
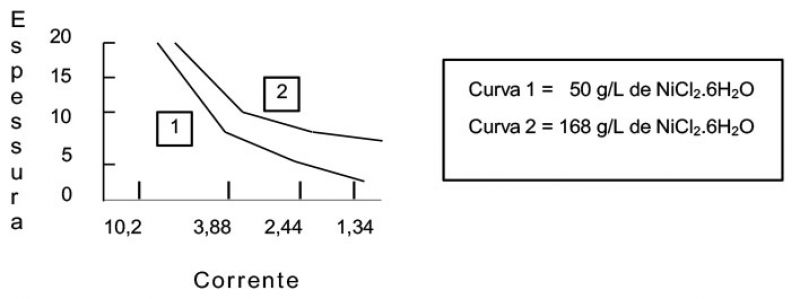
Figura 1 - Espessura do revestimento (em mm) em função da densidade de corrente (em A/dm2) para um banho com 310 g/L de sulfato de níquel, 40 g/L de ácido bórico, pH = 3,7 e temperatura de 55 °C
- aumento do coeficiente de difusão dos íons de níquel: a presença de íons cloreto aumenta o coeficiente de difusão dos íons de níquel. Esse fato aumenta a densidade de corrente limite. A densidade de corrente limite é o valor máximo que pode ser adotado nos processos de eletrodeposição para obtenção de depósitos de qualidade aceitável. Ela corresponde a uma situação na qual a velocidade de deposição do metal não é mais controlada pela diferença de potencial aplicada na interface catodo/banho, mas sim pela difusão dos íons de níquel do seio da solução para a interface. O valor dessa corrente pode ser calculado pela seguinte expressão:

O valor da densidade de corrente limite poderá dobrar na presença de cloretos. O aumento da densidade de corrente limite permite a adoção de maiores valores de densidades de corrente operacionais, portanto maiores velocidade de deposição;
- fonte de íons de níquel: obviamente o cloreto de níquel, ao lado do sulfato de níquel, tem a função de fornecer íons de níquel ao banho;
- aumento da condutividade do banho: o cloreto aumenta significativamente a condutividade dos banhos de níquel, o que permite a adoção de menores valores de diferença de potencial (voltagem) para o mesmo valor de densidade de corrente. O alto poder de penetração dos banhos de níquel com cloretos é devido principalmente ao aumento da condutividade do banho;
- aumento da velocidade de deposição: pelo fato de permitir a adoção de maiores densidades de corrente e aumentar a condutividade do banho, tem-se maiores velocidades de deposição. É por esta razão, que em processos contínuos utilizam-se maiores quantidades de cloreto de níquel;
- aumento da eficiência de corrente: o cloreto aumenta a eficiência de corrente catódica;
- diminuição do consumo de energia: devido ao fato do cloreto aumentar a condutividade do banho e a eficiência de corrente catódica, a diferença de potencial necessária para se obter um mesmo valor de densidade de corrente é menor. Este fato determina diminuição substancial do consumo de energia elétrica;
- diminuição da quantidade do lodo anódico: na presença de teores crescentes de cloreto, há uma tendência dos anodos, que corroem pelo mecanismo de corrosão por pite, passarem a corroer pelo mecanismo de corrosão generalizada. Isto causa diminuição da quantidade de lodo anódico;
- aumento do rendimento do processo: o rendimento do processo de eletrodeposição aumenta com o aumento do teor de cloreto no banho. Este fato é consequência direta do aumento da condutividade do banho e da eficiência de corrente, o que permite, para uma mesma diferença de potencial aplicada, a adoção de maiores densidades de corrente de deposição e portanto maior rendimento.
A presença de íons cloreto nos banhos de níquel apresenta algumas desvantagens a saber:
- na presença de cloretos os eletrodepósitos apresentam maiores tensões internas;
- o banho torna-se mais corrosivo em relação aos componentes metálicos como garras e contatos elétricos;
- o cloreto de níquel é mais caro do que o sulfato de níquel é mais comum ter-se na praça cloreto de níquel contaminado;
- o cloreto de níquel é muito higroscópico e se aglomera durante o armazenamento, dificultando o seu manuseio;
- o cloreto pode sofrer oxidação no anodo, quando passivo, com formação de gás cloro, altamente prejudicial aos banhos de níquel;
4. IMPORTÂNCIA DO pH
Um dos parâmetros mais importantes num banho de níquel é o pH. Nos banhos modernos o pH varia de 2,0 a 4,5, sendo considerado ideal valores de pH entre 3,5 e 3,8. As melhores propriedades do depósito serão obtidas mantendo-se a faixa de pH abaixo de 4.
Durante a eletrodeposição de níquel, invariavelmente, ocorre a formação de gás hidrogênio no catodo, de acordo com a seguinte reação:
![]()
Esta reação traz duas consequências:
- formação de pites devido à aderência de bolhas de hidrogênio no catodo;
- rápido aumento de pH na interface. Nesse sentido, sempre se tem um pH superior na interface catodo/banho do que no seio do banho.
Atualmente, a primeira consequência não constitui um problema, visto que, praticamente sem exceção, nos processos comerciais são utilizados agentes tensoativos que evitam a formação de poros.
Já o aumento de pH na interface traz problemas graves, tornando-se crítico para o caso de banhos em que originalmente já são formulados com pH altos. A literatura cita ainda o fato que na presença de cátions de metais alcalinos, como o sódio e o potássio, a tendência do aumento de pH na interface catodo/banho aumenta drasticamente.
Com o aumento de pH na interface, partículas coloidais de hidróxidos metálicos, principalmente de níquel e de ferro (este último presente no banho como impureza) se formam. Teoricamente, o hidróxido de níquel em solução de apenas sulfato de níquel, começa a precipitar a partir de pH = 4,89 e o hidróxido de ferro numa solução presente como impureza a partir de pH 3,5. No entanto, na prática, acredita-se que a partir de pH = 6 tem-se início de precipitação de hidróxidos. É claro que quanto maior for o pH no seio da solução, mais rápido atinge-se o valor 6 na interface.
A formação de partículas coloidais na interface catodo/banho é muito prejudicial, pois as mesmas se codepositam junto ao níquel causando alterações profundas nos eletrodepósitos, podendo-se citar:
- aspereza: como são coloides, a sua incorporação no depósito pode causar aspereza conforme ilustra a Figura 2;

Figura 2 - Ilustração esquemática da produção de depósitos ásperos devido à incorporação de coloides (hidróxidos metálicos)
- porosidade ou pites: poros ou pites podem se formar se tais coloides aderirem temporariamente no catodo. Durante a permanência do coloide, ocorre a deposição do metal nas suas vizinhanças. Quando o coloide se desprende fica um buraco no local. A Figura 3ilustra esquematicamente este fato.
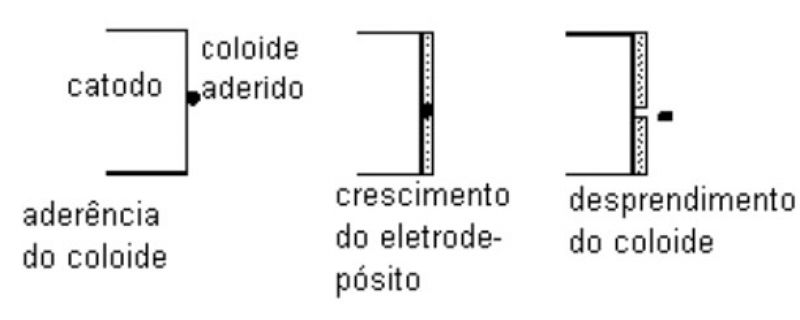
Figura 3 - Ilustração esquemática da formação de depósitos com pites devido à formação de coloides (hidróxidos metálicos).
- mudança na estrutura: as camadas de níquel obtidas a partir de banhos de alta pureza, não aditivados e em condições adequadas de operação são colunares. A incorporação de coloides pode modificar esta estrutura para lamelar;
- refinamento de grãos: a incorporação excessiva de coloides pode causar refinamento de grãos;
- aumento das tensões internas: as tensões internas nas camadas obtidas a partir de banhos com pH mantido na faixa de 3,5 a 4,5 é mínima. No entanto, tais tensões aumentam significativamente com o aumento de pH devido à incorporação de coloides;
- diminuição da dutilidade: a incorporação de coloides diminui a dutilidade dos depósitos de níquel;
- aumento do consumo de aditivos: a precipitação de coloides aumenta drasticamente o consumo de aditivos, principalmente dos agentes tensoativos, devido à grande capacidade de adsorção destes coloides.
Além dos fatos acima citados, o aumento do pH causa ainda passivação do anodo. Quanto maior for o pH, maior será a tendência de passivação do anodo e, portanto, maior será a quantidade de cloretos necessária para a dissolução do anodo. Por exemplo, uma concentração de 17 g/L de cloreto de níquel hexa-hidratado é suficiente para dissolução do anodo quando o pH é menor que 3,7. Para valores maiores de pH, serão necessárias maiores concentrações de íons cloreto. Nos banhos comerciais mais comuns, conforme já citado, costuma-se manter a concentração de cloreto de níquel hexa-hidratado acima de 50 g/L.
Convém, ainda, comentar o fato de que é comum a ocorrência de variação de pH durante o processo de niquelação. Nas condições normais de operação, a tendência é o aumento de pH. O acerto de pH, nesses casos, pode ser feito tanto com ácido clorídrico como com ácido sulfúrico.
Raramente ocorre diminuição de pH, quando ocorre é indicativo de passivação do anodo, baixa área anódica ou mal contato elétrico nos barramentos. O aumento de pH deve ser feito com carbonato de níquel num tanque de tratamento, nunca no tanque de operação. Deve-se efetuar pequenas adições sob agitação e seguir o seguinte procedimento:
- transferir o banho para o tanque de tratamento auxiliar revestido com plástico adequado;
- ajustar a temperatura do banho para (66 a77) °C;
- preparar uma pasta de carbonato de níquel em água, na proporção de 1 kg de carbonato de níquel para 1 litro de água. Agitar esta mistura preferivelmente com agitador mecânico até a sua perfeita dispersão;
- adicionar lentamente a pasta de carbonato de níquel ao banho quente sob constante agitação e controlar o pH.
Não se recomenda o uso de hidróxido de sódio ou de potássio para aumentar o pH dos banhos de níquel. Isso porque, conforme já mencionado, na presença de sais de metais alcalinos, como sódio e potássio, a tendência de aumento de pH na interface aumenta drasticamente.
5. FUNÇÃO DO ÁCIDO BÓRICO
Devido à grande importância do pH nos banhos de níquel, utiliza-se o ácido bórico que é uma substância tampão. Assim, o ácido bórico tem função tamponante, principalmente na interface catodo/banho, onde ocorre mais acentuadamente aumento de pH devido ao consumo de íons H+ com formação de H2.
Uma substância tampão tem a propriedade de se opor às variações de pH de uma solução. Uma descrição sucinta da ação do ácido bórico é a seguinte:
- o ácido bórico é um ácido fraco, e, portanto, dissocia-se parcialmente e se mantém em equilíbrio com os cátions hidrogênio, de acordo com a reação:
![]()
- se houver aumento de pH (diminuição de H+), a reação de dissociação do ácido bórico é desviada para a direita, o que aumenta novamente a concentração de H+;
- se houver diminuição de pH (aumento de H+), a reação de dissociação do ácido bórico é desviada para a esquerda, o que diminui novamente a concentração de H+.
Assim, o ácido bórico funciona como reservatório de íons H+, fornecendo este íon quando sua concentração diminui ou armazenando-o, quando sua concentração aumenta.
Cada substância tampão tem uma faixa (da ordem de 2 unidades) em que atua com maior eficiência. O melhor desempenho do ácido bórico, como tamponante, ocorre na faixa de pH 4 a 6. No entanto, mesmo que o banho de níquel tenha um valor de pH mais baixo, o ácido bórico ainda apresenta um desempenho satisfatório, visto que na interface catodo/banho o pH é sempre mais elevado.
Cabe esclarecer que o ácido bórico é um excelente tamponante de banhos de níquel devido às seguintes propriedades:
- é comercializado com alto grau de pureza;
- apresenta custo relativamente baixo;
- não é volátil;
- é estável nas condições operacionais dos banhos de níquel que operam com baixas densidades de corrente. Para densidades de corrente elevadas o ácido bórico sofre decomposição (a explicação da ocorrência de decomposição do ácido bórico será apresentada a seguir);
- tem função de cooperar com a ação dos agentes niveladores.
Nos banhos mais comuns a concentração de ácido bórico é mantida no mínimo a 40 g/L. No caso de se utilizar densidades de corrente elevadas, recomenda-se aumentar a concentração de ácido bórico para 60 g/L, pois o consumo deste ácido aumenta para valores altos de densidade de correntes.
Deve-se ressaltar que os banhos contendo o ácido bórico em concentrações iguais ou superiores a 40 g/L não podem operar a temperaturas abaixo de 35 °C pois ocorre a sua cristalização. A solubilidade do ácido bórico aumenta com a temperatura: a 0 °C a solubilidade é de 26,2 g/L e a 100 °C é de 402 g/L.
5.1 Estabilidade do ácido bórico nos banhos de níquel
Na literatura consultada, diz-se que o ácido bórico é estável nas condições de operação dos banhos de níquel. No entanto, as mesmas fontes consultadas referem-se ao fato de que a adoção de densidades de correntes elevadas determina maior “consumo” do ácido bórico. Nada foi encontrado sobre o mecanismo com que ocorre tal consumo.
O ácido bórico é um ácido fraco e está presente nos banhos de níquel na forma de H3BO3 e H2BO3-, devido à reação de equilíbrio
![]()
a concentração de cada uma das espécies (H3BO3 e H2BO3-) depende do valor do pH (concentração de H+).
Nos banhos com 40 g/L de ácido bórico, a concentração do ácido bórico é de 0,645 mol/L (lembrando que o mol deste ácido é 62 g).
Antes de dar continuidade, convém lembrar alguns conceitos sobre ácido fracos:
- quando se adiciona um ácido fraco à água, uma pequena parte se dissocia e se mantém em equilíbrio. No caso do ácido bórico, a reação de equilíbrio já mencionada é a seguinte:
![]()
- a concentração de H2BO3- é por estequiometria, igual à concentração de H+. Considerando um banho de níquel de pH variando de 3,5 a 4,5, a concentração de H+ e, portanto, a de H2BO3- varia de 10-4,5 mol/L a 10-3,5 mol/L, portanto muito baixa;
- como a concentração de H2BO3- é muito baixa, a quantidade de ácido bórico que se dissocia é muito pouca, podendo se supor que a concentração de H3BO3 é praticamente igual àquela adicionada ao banho, ou seja 0,645 mol/L;
- considerando um valor de pH médio igual a 4,0 pode-se afirmar que num banho de níquel, tem-se as seguintes concentrações molares:
[H3BO3] ≅ 0,645 mol/L
[H+] = 10- 4 mol/L
[H2BO3-] = 10- 4 mol/L
As duas espécies do ácido bórico presentes no banho de níquel podem sofrer reações de oxirredução na superfície de um eletrodo sólido, a saber:
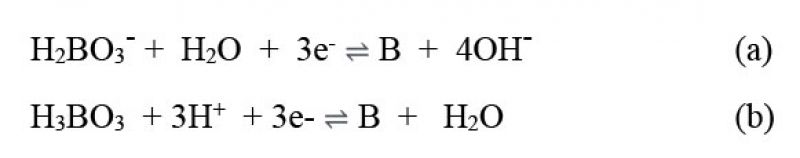
O potencial de equilíbrio da reação (a) calculado para a concentração de 10-4 mol/L de H2BO3, pH = 4 e a 60 °C é de -1,66 V, EH (eletrodo padrão de hidrogênio) e o potencial de equilíbrio da reação (b) calculado para a concentração de 0,645 mol/L de H3BO3, pH = 4 e a 60 °C é de -1,13 V, EH.
Conhecendo-se os potenciais de equilíbrio, pode-se afirmar que:
- a espécie H2BO3- poderá sofrer decomposição durante a niquelação, se o potencial, na interface catodo/banho atingir valores inferiores a -1,66 V, EH;
- a espécie H3BO3 poderá sofrer decomposição durante a niquelação, se o potencial na interface catodo/banho atingir valores inferiores a -1,13 V, EH.
Pelo exposto, é possível ocorrer a decomposição de ácido bórico nos processos de niquelação se as condições operacionais forem tais que o potencial da interface catodo/banho atinja valores inferiores a -1,13 V, EH. Vejamos em que condições é possível ocorrer esta situação.
O potencial de equilíbrio do níquel num banho tipo Watts é da ordem de -0,26 V, EH. Para se depositar o níquel, aplica-se na interface catodo/banho valores de potenciais menores do que esse valor. Quanto menor for este potencial, maior será a densidade de corrente de deposição do níquel. Assim, para densidade de corrente muito elevada é possível atingir valores inferiores a -1,13 V, EH.
Assim sendo, conclui-se que o ácido bórico poderá sofrer decomposição durante a niquelação. Essa decomposição é maior quando se utiliza altos valores de densidade de corrente.
Assim, consegue-se entender a razão pela qual a literatura recomenda a adoção de maiores concentrações de ácido bórico (60 g/L) quando se adota maiores densidades de deposição.
6. BIBLIOGRAFIA CONSULTADA
BRUGGER, R. Nickel plating. 1.ed. Teddington : Robert Draper, 1970. 363p.
DENNIS, J. K.; SUCH, T. E. Nickel and chromium plating. 1.ed. London : Newnes-Butterworths, 1972. 324p.
KUSHNER, J. B. Electroplating know how II: lesson 8. 1972 47p.
LOWENHEIM, F. A. Modern electroplating. 3ed. New York : John Wiley, 1974. 801p.
METAL FINISHING. New Jersey : Metals and Plastics Publications, v.8, n.12, dec. 1989. 76p.
METALS handbook. 9 ed. Metals Park : ASM, 1987. 17v. v.5 : surface cleaning, finishing and coating. 715p.
NEW Encyclopaedia Britannica. 15 ed. Chicago : Encyclopaedia Britannica, 1973. p.691-693
PANOSSIAN, Z. Corrosão e proteção contra corrosão em equipamentos e estruturas metálicas. 1.ed. São Paulo : Instituto de Pesquisas Tecnológicas, 1993. 2v. 636p. (Publicação IPT 2032)
PANOSSIAN, Z. Mecanismos de eletrodeposição de metais. (não publicado)
PRATICAL Nickel plating. New York : INC. 56 p.
SAFRANEK, W. H. Properties of electodeposited metals and alloys : a handbook. New York : American Elsevier, 1974. P.219-288
WATSON, S. A. Nickel electroplating solutions. England : NiDi, 1989. (NiDi technical series n. 10047)
WESLEY, W. A.; PRINE, W. H. Pratical nickel plating. New York : INC. 44p.
WATTS, O.P. Trans. Am. Electrochem., v. 29, 1916, p.395-403 , M.; IVES, M. B. Effect of chloride concentration on the anodic dissolution behaviour of nickel. Corrosion, NACE, v. 29, n.8, Aug., 1973. p.319-324












