Da parte histórica às mais modernas técnicas de controle de qualidade físico e químico na área galvanotécnica

INTRODUÇÃO
O tratamento superficial de um substrato para a finalidade decorativa ou funcional pode ser feito através de vários meios, químicos ou físicos, e há grande diversidade de possibilidades disponíveis com tecnologias privadas ou abertas. Além dos processos galvanotécnicos, que representam a maioria das possibilidades de tratamentos superficiais, há outros, sendo os mais conhecidos: a galvanização a fogo, pintura, tratamento térmico, deposição física a vapor (PVD), deposição química a vapor (CVD), Dip Spin Coating, Spray Coating.
Este artigo trata especialmente dos processos galvanotécnicos, entretanto, se aplica também aos outros processos.
Em definição autoral, pode-se dizer que processos galvanotécnicos “são meios para obtenção do tratamento superficial de quaisquer substratos metálicos ou não metálicos que se utilizam de sequências de processos químicos, cujas soluções químicas estão contidas em tanques abertos onde, em cada passo do processo durante a imersão do substrato nas soluções químicas, são requeridas condições específicas na operacionalização para que ocorram reações químicas, espontâneas ou não espontâneas, resultando em deposição das camadas superficiais (eletrodeposição de metais ou ligas metálicas, redução auto catalítica de metais e ligas, deposição química de metais e substâncias químicas) ou na formação de camadas internas no substrato, sendo necessário o uso de corrente elétrica (eletrólise) ou não (tratamento químico), requerendo controle dos parâmetros físicos e químicos”.
Na galvanotécnica, ramo da química (eletroquímica), é prioritário conhecer e entender como as reações químicas acontecem, ou seja, é preciso ter domínio e monitorar os eventos que ocorrem na operacionalização dos processos galvânicos qualificando-os, quantificando suas características constituintes, parâmetros físicos e químicos, para o bom funcionamento da produção, segundo as leis da física e da química que regem seu funcionamento.
Empreender na atividade requer profissionalização, conhecimento e contínua aprendizagem.
Bases do conhecimento científico aplicadas à galvanotécnica
Para melhor compreensão, segue breve histórico e descritivo das principais leis da Física e da Química, dentre outras, aplicáveis aos processos galvânicos que requerem uso de corrente elétrica para as suas reações.
Leis de Ohm - No século 19, na cidade de Colônia, Alemanha, no ano de 1827, o físico e matemático Georg Simon Ohm publicou resultados de seu trabalho dando conta de que a corrente elétrica que atravessa um fio condutor é proporcional à diferença de potencial aplicada à área da seção transversal do fio e inversamente proporcional ao comprimento. A primeira lei de Ohm trata da proporcionalidade entre corrente elétrica, I (amperes), e a diferença de potencial, V (volts), que há entre materiais condutores, também chamados condutores ôhmicos quando à temperatura constante dessa lei for verdadeira. A razão V / I determina a tensão necessária a ser aplicada para passar uma dada corrente em um dispositivo de circuito elétrico. Quanto maior for a dificuldade que o dispositivo impõe à passagem da corrente, maior deve ser a tensão aplicada para estabelecer um certo valor de corrente. A razão V / I resulta da dificuldade imposta pelo dispositivo à passagem da corrente elétrica e por isso é denominada de resistência elétrica, R, (Ohm ou Ω). A 1ª lei de Ohm é expressa pela equação (1) V = R. I
A 2ª lei de Ohm mostra que a resistência elétrica é proporcional ao comprimento do condutor, ? (m), e inversamente proporcional a área da seção transversal, A (m2), e o coeficiente de proporcionalidade é conhecido como resistividade elétrica, R, (ohm-metro ou Ω m) expressa pela equação (2): ρ = (R. A) / ? (IFSC, 2015). Logo, para determinar a tensão entre dois eletrodos na eletrólise usa-se a equação (3): V= (I. ρ. ?) / A (considera-se ? a distância entre eletrodos).
Eletrólise - É um fenômeno físico-químico não espontâneo que ocorre em soluções químicas, eletrólitos, onde há eletrodos imersos no meio, conectados através de um circuito elétrico. A energia elétrica é a força motriz para que ocorram reações químicas onde há cessão de elétrons para cátions e doação de elétrons para ânions (FELTRE; SETSUO, 1974).
A descoberta de fenômenos bioelétricos culminou com o desenvolvimento da pilha, no final do século 18, após disputa entre o físico italiano Alessandro Giuseppe Antonio Anastasio Volta com o médico e físico Luigi Galvani, e resultou na criação da primeira pilha, em 1800, por Volta (BERTORELLE, 1977).
William Nicholson, físico inglês, e Anthony Carlisle, médico e professor, foram os primeiros cientistas a registrar os resultados do experimento com eletrólise da água observando a liberação de oxigênio no anodo e hidrogênio no cátodo, em 1800, na Inglaterra. A partir de então, o termo eletrólise passou a ser usado e a ciência da eletroquímica se desenvolveu (ZOULIAS; VARKARAKI; LYMBEROPOULOS; et al, 2015).
Leis de Faraday - No contexto histórico do desenvolvimento científico, Michael Faraday, entre 1833 e 1834, foi o primeiro cientista a estabelecer as leis que regulam a eletrólise, um fenômeno físico-químico não espontâneo, conhecidas como 1ª e 2ª Leis de Faraday (BERTORELLE, 1977).
Experimentos eletroquímicos foram realizados em cela eletrolítica; consistia em dois eletrodos conectados através de um circuito elétrico, imersos em uma solução química (eletrólito) capaz de conduzir eletricidade. Os eletrodos são condutores elétricos ligados a uma fonte elétrica que promovem a passagem de corrente elétrica através do eletrólito. Faraday descobriu que, ao circular uma carga, quantidade de eletricidade pelo eletrólito, ocorre descarga de uma massa de íons nos eletrodos, chamando de anodo, o polo positivo, e cátodo, o polo negativo do circuito eletroquímico (GERISCHER,1996).
A 1ª Lei de Faraday estabeleceu que a massa de substância libertada nos eletrodos na eletrólise é diretamente proporcional à carga que passa através do eletrólito e é completamente independente de outros fatores. É expressa pela equação (4) M= K. Q , onde M é a quantidade em gramas de substância depositada; K é o coeficiente de proporcionalidade, chamado equivalente eletroquímico da substância; e Q é a quantidade de eletricidade ou carga elétrica, em Coulombs, que passa pelo eletrólito.
A 2ª Lei de Faraday estabeleceu que na eletrólise, com diversos eletrólitos usando a mesma quantidade de eletricidade, há liberação de quantidade de massa proporcional ao equivalente grama da substância, E, expressa pela equação (5) M= K.E. Disto resulta que as equações (4)+(5), tornam-se a equação (6): M= K.Q.E.
A carga de corrente elétrica pode ser expressa pela equação (7): Q= i.t, onde ‘i’ é a intensidade de corrente elétrica em amperes, e ‘t’ é o tempo em segundos (GLINKA, 1970). Coulomb, C, é a carga elétrica, a quantidade de eletricidade transportada em 1 segundo por uma corrente de 1 ampere (INMETRO, 2012).
A constante de Faraday, F, foi verificada experimentalmente (FELTRE; SETSUO,1974), sendo expressa pela equação (8) atualizada: F = 1 / 96485,3251 C90 mol-1. O significado da constante de Faraday, F, cujo valor atualizado é de 96485,3251 C90 mol-1, conforme Codata (2014), na eletrólise é: carga elétrica que ao passar pelo circuito eletroquímico é o produto da constante de Avogadro, NA, 6,022 140 857 x 1023 mol-1, multiplicado pela carga elementar do elétron-volt, e, 1,602 176 6208 x 10-19 J, expresso pela equação (9): F= NA.e. (VOGEL, 1988).
Equivalente grama, E, de um elemento, substância ou íon, é sua massa expressa em gramas, numericamente igual ao respectivo equivalente químico, a, ou seja, o quociente do átomo-grama do elemento, A, pela sua valência, z, dado pela equação (10) a = A / z. Outra definição necessária para a eletrólise é o equivalente eletroquímico, Eq, expresso em gramas, depositadas por um ampere em um segundo, isto é: a quantidade de substância eletrolisada ou depositada quando se faz passar uma carga de 1 Coulomb durante 1 segundo na solução, expresso pela equação (11): Eq = E / F. Assim, podemos escrever a equação geral da eletrólise (12): M = (1 / F). E. i. t ou M= (1 / F). Q. E.
Equivalentes eletroquímicos são valores teóricos referidos a um rendimento de 100% na eletrólise. Entretanto, a eletroquímica é governada pelas Leis de Ohm e Leis de Faraday (VOGEL, 1988). O rendimento de cada processo deve ser experimentado, principalmente, valendo-se de metodologias de estudo do ‘throwing power’, um comparativo da quantidade e poder de redução de metais no cátodo e polarização do eletrodo sob diferentes condições de operacionalização, usando a célula de Haring-Blum, importante método de estudo do rendimento catódico dos processos. A diferença para a célula de Hull é o formato e disposição dos eletrodos, a célula de Haring-Blum fornece resultados quantitativos e a célula de Hull resultados quantitativos e qualitativos.
Lei Periódica dos Elementos Químicos - Estudos para organizar os elementos químicos de acordo com suas propriedades foram realizados por vários químicos e físicos desde o século 18, culminando na formulação da lei periódica dos elementos químicos e na organização da primeira versão da tabela periódica, em 1869, figura 1, pelo químico e inventor russo Dmitri Ivanovich Mendeléev (1834-1907), que ordenou cartas em uma mesa, em ordem crescente de massas atômicas, agrupando-as em elementos de propriedades semelhantes, usando uma carta para cada um dos 63 elementos conhecidos à época – cada uma constituída pelo símbolo, a massa atômica e as propriedades físicas e químicas do respectivo elemento, formando a tabela periódica primitiva.
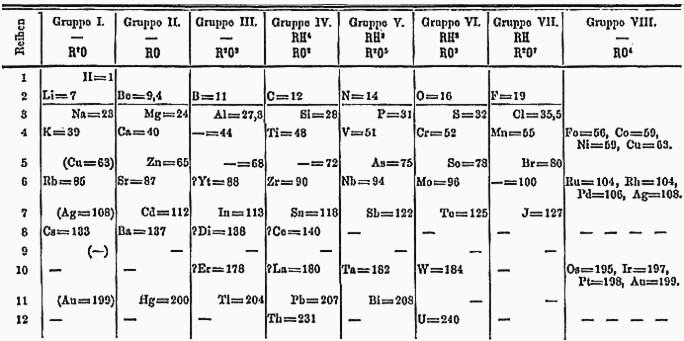
Figura 1 – Tabela periódica de Mendeleev – 1869
(fonte: https://en.wikipedia.org/wiki/Dmitri_Mendeleev#/media/File:Mendelejevs_periodiska_system_1871.png)
Atualmente, a tabela periódica possui 118 elementos químicos, organizados pela União Internacional de Química Pura e Aplicada, IUPAC, vigente desde 2016, figura 2 –, ordenados em períodos (linhas) e grupos ou famílias (colunas) por seus números atômicos, configuração eletrônica e recorrência das propriedades periódicas.
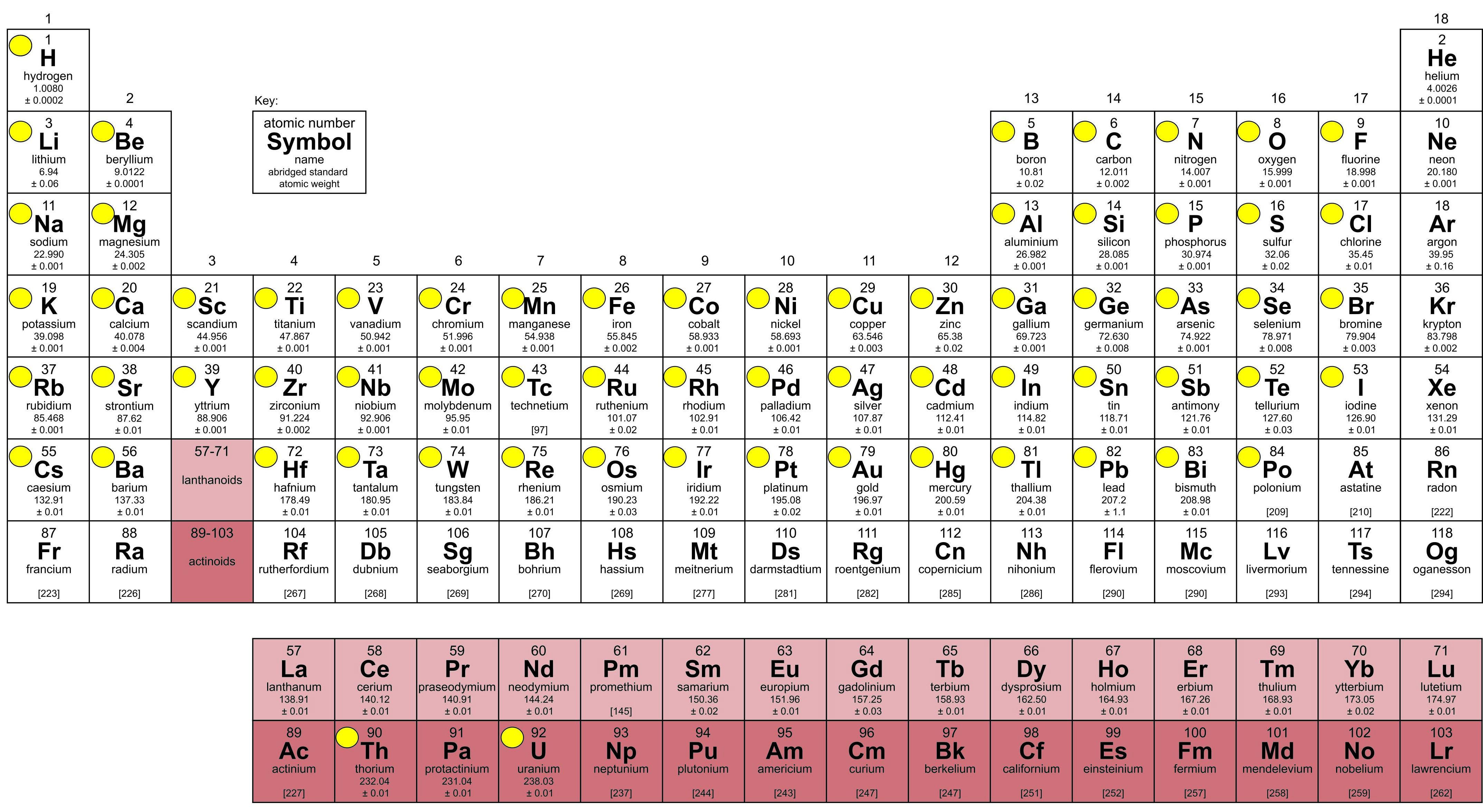
Figura 2: Última versão da tabela periódica – Círculos em amarelo inseridos pelo autor, representando diferentes processos galvanotécnicos (Fonte: https://iupac.org/wp-content/uploads/2022/05/IUPAC_Periodic_Table_150-04May22.jpg)
A IUPAC “é uma organização científica neutra e objetiva, estabelecida em 1919 por químicos acadêmicos e industriais que compartilhavam um objetivo comum – unir uma comunidade química global fragmentada para o avanço das ciências químicas por meio da colaboração e da livre troca de informações científicas. Ao longo de sua história, a IUPAC cumpriu esse objetivo através da criação de uma linguagem comum e da padronização de processos e procedimentos, e é a autoridade mundial em nomenclatura e terminologia química, incluindo a nomeação de novos elementos na tabela periódica, em métodos padronizados de medição, em pesos atômicos e muitos outros dados avaliados criticamente.”
Dos 118 elementos químicos, cerca de 66 (marcados com círculo amarelo na figura 2) estão presentes em diferentes processos galvanotécnicos. Além de alguns elementos químicos serem os principais constituintes de uma determinada solução química ou eletrólito, outros elementos poderão contaminar a solução, principalmente por meio de arraste, dissolução e solubilização de gases, alterando significativamente parâmetros operacionais previamente estabelecidos e causando prejuízos variados.
Como dimensionar uma planta galvânica sustentável e o controle da qualidade físico e químico dos processos e camadas
Consideradas as informações acima, foi elaborado um estudo para um cliente, para a produção de uma determinada peça de substrato ferroso com revestimento de cobre-níquel-cromo. O primeiro passo do estudo foi a definição da massa de cada metal a depositar e os respectivos tempos dos processos necessários nas condições previamente selecionadas para densidade de corrente a aplicar em cada etapa de eletrólise – dados a serem utilizados no cálculo do custo de produção e preço de venda do serviço de galvanoplastia, não mencionados neste texto.
Trata-se de uma peça cujo substrato ferroso é estampado em material SAEJ403-201406, grau 1010, para atender aplicação na indústria automobilística, área a revestir com 1 dm2, cuja especificação deve atender ASTM B-456-17 – tabela 2– Fe/Cu15a Ni30d Cr mp.
O desenho do cliente pede 16-20 µm de cobre; 15-18 µm de níquel semibrilhante; 16-20 µm de níquel brilhante; 0,15 -0,45 µm de cromo decorativo, com peça a ser produzida em gancheira. A tabela 1, a seguir, mostra equivalente eletroquímico de acordo com sua valência para os elementos cobre, níquel, cromo; demonstra camadas, pesos dos metais e tempos necessários para produzir determinada especificação de revestimento de uma peça.
Após a elaboração da tabela 1 com as informações necessárias, foram reunidas informações específicas relativas aos métodos normatizados e que representam o atual estado da arte para realizar o “controle físico e químico da qualidade na galvanoplastia”.
Foram tabulados a maioria dos métodos analíticos qualitativos e quantitativos para manutenção de parâmetros operacionais dos elementos e substâncias químicas que compõem os processos e avaliação dos revestimentos obtidos, tabelas 2 e 3, tanto para garantir ao cliente as características requeridas do revestimento, a rastreabilidade dos processos e sua operacionalização, quanto para a sustentabilidade da galvanoplastia, objetivando salvar recursos naturais do planeta por meio do melhor aproveitamento dos processos, reduzindo ou até eliminando geração de resíduos para mitigação e, em diversas situações, recuperando e reutilizando recursos naturais como água e metais com uso de tecnologias específicas.
Cada solução – ou eletrólito – formulada para uso em etapas dos processos galvânicos possui características próprias para seu funcionamento e limites de tolerância em contaminações por outros elementos químicos. Uma linha galvânica requer controle físico e químico da qualidade por meio de análise química qualitativa (via seca e úmida), análise química quantitativa (por via ponderal, volumétrica e instrumental), com as seguintes determinações: física, físico-química e eletroquímica, conforme as metodologias citadas nas tabelas 2 e 3. O trabalho pode ser feito em laboratório próprio, na galvanoplastia, ou por meio de terceiros – lembrando que os fornecedores de processos prestam auxílio, geralmente, quando há necessidade de assistência técnica em processos proprietários, mas quando se trata de cumprir procedimentos internos e atendimento a requisitos de normas técnicas, é necessário recorrer aos laboratórios acreditados RBC- INMETRO (Rede Brasileira de Calibração - Instituto Nacional de Metrologia, Qualidade e Tecnologia).
Tabela 1 - Peso de metal, densidade de corrente e tempo necessários para depositar várias camadas metálicas, cobre-níquel-cromo em substrato ferroso, base do estudo de um processo galvânico.

Tabela 2 - Principais metodologias para controlar parâmetros físicos, físico-químicos e eletroquímicos em soluções químicas usadas na galvanoplastia e revestimentos

Tabela 3 - Principais metodologias para controlar parâmetros químicos em soluções químicas usadas na galvanoplastia e revestimentos

A normatização internacional para tratamentos superficiais é extensa, abrangendo a quase todos os aspectos físicos e químicos dos processos e revestimentos produzidos – há marcos regulatórios das atividades, de conformidade legal ambiental, de saúde ocupacional e de operacionalização de uma planta galvânica.
Na galvanoplastia, para cumprir um objetivo, há uma sequência de processo adequada, em função do substrato metálico ou não metálico a ser trabalhado; são utilizadas soluções químicas operacionalizadas com auxílio de corrente elétrica (banho eletrolítico) ou sem a sua necessidade (banho químico), em condições específicas para cada etapa do processo. Podemos classificar os processos em três categorias: ‘pré-tratamento’; ‘tratamento’; ‘pós-tratamento’.
No pré-tratamento, o substrato é preparado através da eliminação de sujidades, contaminações metálicas e orgânicas, como óleos, graxas e outros produtos usados no processo de fabricação mecânica – através de desengraxante, decapagem e ativação da superfície a revestir.
No tratamento, ocorre a formação do revestimento com as camadas desejadas de acordo com as especificações de cada tipo de processo.
No pós-tratamento, o revestimento recebe a proteção adicional necessária, que pode ser: neutralização, passivação, adsorção de substâncias inorgânicas e orgânicas, tratamento térmico, etc.
Entre cada uma das etapas, há necessidade de lavagem em água de qualidade a fim de se evitar contaminação no estágio seguinte.
Considerando que um processo galvânico tem diversas etapas, demonstra-se, aqui, o clássico processo de deposição de camadas de cobre-níquel-cromo, muito utilizado em revestimentos decorativos, e que também pode ser aplicado em revestimentos técnicos funcionais com cromo duro.
Neste estudo, conforme citado anteriormente, temos a peça em substrato ferroso estampado, área a revestir com 1 dm2, cujo desenho do cliente pede 16-20 µm de cobre; 15-18 µm de níquel semibrilhante; 16-20 µm de níquel brilhante; 0,15 -0,45 µm de cromo decorativo.
Definida a melhor sequência de processos para a produção das peças na galvanoplastia, com a menor geração de resíduos, sendo portanto, uma galvanoplastia sustentável, veja, na tabela 4, a seguir, uma linha manual considerando operacionalização em gancheira.
Tabela 4 - Sequência galvânica para eletrodeposição de cobre-níquel-cromo em substrato ferroso

De posse das informações do desenho, das tabelas 1 e 4, e da necessidade de domínio e controle do processo, foi definido como realizar o controle da qualidade físico e químico para monitoramento, rastreabilidade e garantia contratual dos parâmetros de operação de cada passo do processo e do revestimento final, conforme a tabela 5, a seguir.
Tabela 5 - Parâmetros considerados para o monitoramento, rastreabilidade e garantia

A decisão de implantar internamente, no projeto da planta galvânica, uma estrutura operacional de laboratórios próprios ou terceirizar os serviços deve ser avaliada à parte, considerando elevado investimento na aquisição de equipamentos, atendimento à extensa normatização da qualidade – com a questão da obrigatoriedade da calibração instrumental por fornecedor credenciado na RBC-INMETRO; bem como se deve fazer um estudo de utilização dos laboratórios conforme definição das frequências de inspeção e monitoramento por meio do controle de qualidade físico e químico dos processos e revestimentos.
Definida a sequência do processo da planta galvânica, os requisitos e a metodologia do controle da qualidade, a fase seguinte é dimensionar o projeto da linha, considerando a necessidade produtiva do cliente para 1, 2 e 3 turnos de trabalho e, também, definir qual a melhor relação custo-benefício e menor necessidade de investimentos para cada situação contratual.
Nessa fase, são definidos todos os equipamentos necessários para operacionalização de cada etapa dos processos, considerando a galvanoplastia como atividade industrial potencialmente poluidora, e avaliando causa e efeito desses processos industriais. O planejamento e o projeto de uma galvanoplastia sempre devem considerar uma menor utilização de recursos naturais, especialmente da água, da matéria-prima química, e da energia elétrica, com a implantação de técnicas e tecnologias possíveis de se atingir produção mais limpa, objetivando a sustentabilidade.
Diversas tecnologias permitem produção mais limpa na galvanotécnica, sem causar impactos ambientais e degradação do meio ambiente. É fundamental observar a regulamentação da atividade galvanotécnica pelas normas legais e técnicas para conformidade ambiental, aplicável em cada região.
Nas últimas décadas, a evolução e inovação tecnológica foram aplicadas para os equipamentos galvanotécnicos das linhas de produção e para minimizar, eliminar e mitigar os resíduos gasosos, líquidos e sólidos. Para ilustrar, temos como exemplo o desenho de linhas galvânicas com lavadores em sistema cascata no contrafluxo aos processos em regime de circuito fechado; retificadores pulsantes de alta eficiência, de pulso reverso, tradicionais; tambores rotativos que trabalham como se fossem gancheiras; exaustão acoplada em carros transportadores e linhas enclausuradas; anodos dimensionalmente estáveis; complexantes não cianídricos; produtos químicos formulados de menor impacto ambiental; sistemas de filtração e purificação para todos os tipos de tamanhos de partículas contaminantes; materiais de alta resistência à corrosão para uso nos equipamentos; softwares gerenciadores de processos para a indústria 4.0; motores elétricos de alta eficiência energética; iluminação de baixo consumo energético; sistemas de secagem de peças de alta eficiência; eletrólitos de alto rendimento eletroquímico; entre outros.
Nos tópicos abaixo estão as principais considerações para elaboração do projeto de uma planta galvânica sustentável de acordo à conformidade legal ambiental:
- O projeto deve contemplar a construção ou adaptação das instalações e obras civis e o uso de materiais alternativos e reciclados. Captar, armazenar e usar água de chuva nas edificações e nos processos galvanotécnicos é possível com pouco investimento. Nos edifícios, pode-se incluir tecnologias para tratamento do esgoto doméstico, dos sanitários e dos restaurantes. Gerar energia elétrica através de fontes alternativas, como luz solar ou vento, também já é viável com energia solar, usando placas fotovoltaicas; ademais, o uso da luz natural deve ser priorizado nos edifícios de forma a usar pouca luz artificial para os sistemas de produção.
- O layout da planta galvânica deve possuir contenção segregada contra derramamentos, com poço de emergência para coleta. Todas as áreas do edifício com atividade de manipulação de produtos químicos devem possuir impermeabilização dos pisos e, em alguns casos, das paredes até a altura de trabalho da linha.
- Buscar eficiência para os maiores consumidores de recursos naturais na galvanoplastia: evitar uso de equipamentos de baixa eficiência energética (motores, retificadores, aquecedores, refrigeradores, e outros), a substituição de banhos exauridos, e sequências curtas nos sistemas de lavadores das linhas galvânicas – quanto menor o número de passos de processos, maior consumo de água e, consequentemente, maior volume de lançamento para mitigar em sistemas de tratamento de águas residuárias, com maior quantidade de resíduos.
- Os tanques de processos eletrolíticos devem ser corretamente desenhados para suportar o meio e as condições físicas – os condutores elétricos suportam a intensidade de corrente elétrica necessária e o uso de retificadores de alta eficiência permite salvar recursos naturais de energia elétrica e metais.
- Gancheiras devem ser desenhadas para suportar a corrente elétrica, e com menor área de contato sem isolação – também para minimizar o arraste das soluções no momento da transferência de um passo de processo ao outro. Tambores rotativos devem ser desenhados para trabalhar como gancheiras e possuir maior área furada.
- Os lavadores devem ser cascata em contrafluxo ao processo, e quanto maior o número de lavadores, menor o lançamento de resíduos líquidos a mitigar, resultando menor quantidade de resíduos sólidos – podendo até não ocorrer geração de resíduos se implantar sistemas de reuso em regime de circuito fechado na última posição de lavagem dos lavadores cascata, de cada etapa química ou eletrolítica do processo, (ARAÚJO, KATZ, 2009). Se não houver possibilidade de implantar sistemas lavadores cascata contrafluxo em regime de circuito fechado, a segregação das correntes de efluentes por seletividade dos metais (neste trabalho: cobre, níquel e cromo, mitigados seletivamente) resultam em substâncias químicas conhecidas que podem virar novas matérias-primas por reciclagem e reprocessamento.
- Quanto às matérias-primas usadas nos processos, muitas podem ser substituídas e recuperadas de forma a minimizar o custo de tratamento e de disposição de seus resíduos. Não há maiores problemas que sódio, potássio e sulfato nos processos galvanotécnicos, pois, exceto sulfato, sódio e potássio, não constam dos parâmetros legais para lançamento de águas residuárias tratadas nos sistemas coletores da rede pública – embora sejam o grande problema a mitigar, juntamente com substâncias POP’s e disruptores endócrinos presentes nas formulações proprietárias dos processos, na atualidade. Cianeto, cromo, e alguns metais pesados (por exemplo chumbo e cádmio) são fáceis de substituir ou mitigar.
- As linhas galvânicas podem ser enclausuradas e devem conter sistemas de exaustão e lavagem de gases corretamente dimensionados. O uso de ventilação natural deve ser priorizado.
Tecnologias para minimizar e mitigar resíduos na galvanoplastia
Destacam-se, a seguir, possibilidades para recuperação, reuso de água e matéria-prima, através de tecnologias terciárias para tratamento dos efluentes, que permitem melhorar os resultados quando comparados apenas aos processos físico-químicos tradicionais (ARAÚJO, 2020):
- Resinas de trocas iônicas seletivas com a finalidade de capturar metais como cobre, níquel, cobalto, ouro, etc., quando regeneradas, resultam em matéria-prima que pode ser reutilizada diretamente nos processos. O rendimento dessa tecnologia é de 95%, em média. A água presente nas soluções também pode ser reutilizada.
- Similar as resinas de trocas iônicas, o uso das tecnologias de membranas, como osmose reversa, ultrafiltração e nanofiltração, também permitirá resultados interessantes no salvamento de recursos naturais. O rendimento médio desses processos é de até 90% para nanofiltração e de até 60% para osmose reversa. Esses processos permitem recuperação de parcelas de água em até 50%.
- O uso de sistemas de destilação a vácuo permitirá salvar recursos naturais da mesma forma, com rendimentos de até 92%.
- Sistemas eletrolíticos, como eletrodiálise, por exemplo, permitem remoção de frações de metais em níveis de ppb dos efluentes; também resultam em grande rendimento, superior a 95%, e são seletivos.
- Sistemas eletrolíticos conhecidos como electrowinning são bastante utilizados, especialmente, no setor de mineração, e resultam em rendimento variável de acordo com o tipo de eletrólito que é processado, em uma faixa de 50 a 98%.
- A eletrocoagulação-flotação é ideal para tratar efluentes onde não há metais de interesse para recuperação, como aqueles derivados do pré-tratamento; e também efluentes contendo altas cargas de óleos, anilinas, tintas, fosfatos, manganês, etc.
- A oxidação de metais por sistemas de ozonização tem conquistado adeptos no setor galvanotécnico, especialmente para a destruição de cianetos – embora os investimentos para esse fim ainda sejam proibitivos.
- O uso de luz ultravioleta em tratamento de efluentes está destinado a desinfecção de microrganismos patogênicos; em algumas situações é necessária a adoção desse sistema em linha, com foco no reuso de água em circuito fechado.
- Os processos oxidativos avançados usando reagente de Fenton têm crescente aplicação no tratamento de efluentes galvânicos, contendo maior quantidade de complexos cianídricos, compostos orgânicos, nitrogênio amoniacal e nitrogênio total. Esses processos são geralmente combinados com outras técnicas e, muitas vezes, o melhor rendimento é observado em etapas finais de tratamento. O rendimento para esses processos pode chegar a 90%.
CONCLUSÃO
Ao se adotar um procedimento semelhante ao descrito neste trabalho – para definição de uma sequência de processo galvânico sustentável e em como proceder o controle físico e químico da qualidade dos processos e das camadas –, certamente, se compreenderá a dimensão da atividade galvanotécnica, fundamentalmente baseada na eletroquímica, ramo da química que mais produziu inovação tecnológica nos últimos 250 anos.
Recente enquete autoral a respeito de como está sendo feito o controle de qualidade dos processos nas galvanoplastias, respostas, de apenas 13 empresas, indicaram que 53% têm controle total de seus processos, 23% dependem integralmente de seus fornecedores; 15% não possui controle algum; 7% realizam controle parcial.
A principal questão a ser definida quando se trata de qualidade dos processos galvanotécnicos é o entendimento dos limites entre as responsabilidades do fabricante dos processos e as do usuário. O fabricante oferece garantia de que seus processos funcionam de acordo com o que está escrito em seu boletim técnico e limita-se a garantir o funcionamento, desde que os processos sejam operacionalizados dentro dos parâmetros de controle requeridos em sua literatura técnica, uma vez que não compete ao fabricante a operacionalização da linha galvânica, enquanto a qualidade obtida durante o uso e consumo do processo é de integral responsabilidade do usuário e de suas instalações produtivas.
Infelizmente, é comum observar situações em que o usuário reclama do processo galvânico, argumentando que não funciona, porém, ao se verificar as condições operacionais na galvanoplastia, a primeira descoberta é a de não conformidade em relação a ‘hardware e técnica’ na operacionalização – às vezes, sem qualquer controle e conhecimento técnico para operação. A mudança de um fornecedor de processos para outro requer, além de verificação de sua compatibilidade, principalmente, tempo para que o novo processo substitua integralmente o antigo – e isso só acontece com o consumo integral do processo anterior. Não se deve trocar de fornecedor apenas por diferença de preço do produto, é preciso avaliar a relação custo-benefício para a troca – o trabalho e o tempo darão as respostas. Não existe processo de qualquer fabricante disponível à venda no mercado que não funcione, quando se trata de eletrólise e deposição de metais, se forem observadas as informações e condições de trabalho descritas nos boletins técnicos, o que difere um processo de outro, impactando no preço de venda é sua formulação, inovação tecnológica e know how do fabricante.
A mudança do paradigma de galvanoplastia insustentável – que ainda existe no mundo todo – será possível quando houver a conscientização da necessidade de profissionalização e a introdução de sistemas de produção mais limpa, como descrito neste artigo, migrando para um novo modelo de galvanoplastia sustentável. Aos poucos já se percebe mudanças no cenário, mas é preciso agir mais rápido.
Finaliza-se este artigo com a proposição ao leitor para refletir a respeito da profissionalização, competitividade e sustentabilidade da indústria galvanotécnica brasileira.
REFERÊNCIAS
ARAÚJO, P. de. Galvanoplastia (in) sustentável. Revista Tratamento de Superfície: Revista da Associação Brasileira de Tratamento de Superfícies ABTS, São Paulo, edição n° 216, p. 38-43, setembro 2019. Disponível em (https://abts.org.br/images/img-publicacoes/tratamento_de_superficie-216/rts-216.pdf) , acesso em 9.11.2020.
ARAÚJO, P.; KATZ, J. Descarte zero de efluentes galvânicos - uso do reator de eletrocoagulação-flotação de alta eficiência combinado com resinas de troca iônica para tratamento de efluente de galvanoplastia. In: XIII- Ebrats - Encontro e Exposição Brasileira de Tratamentos de Superfícies, Anais, São Paulo - Brasil, 2009.
BERTORELLE, E. Trattato di galvanotecnica. Milão, Itália, Ed. Ulrico Hoepli, 4ª edição. Vol. II, 1977. p.825-1102
CODATA. NIST data. Disponível em (http://physics.nist.gov)/cgi-bin/cuu/Value?f90|search_for=faraday), acesso em 24/9/2015
FELTRE, R.; YOSHINAGA, S. Físico-Química. São Paulo, SP, Ed. Moderna, 2ª ed. p.197, 1968.
GERISCHER, H. et all. The CRC Handbook of solid state electrochemistry. New York, USA, CRC Press, Inc. cap.2, p.19, 1997.
GLINKA, N.L. Problems in general chemistry. Moscow, USSR, Ed. Mir Publishers, p.201-203, 1973.
IFSC. Resistência e corrente elétrica. Apostila Laboratório de eletricidade e magnetismo. Ed. Universidade de São Paulo, São Carlos, SP, 2015, disponível em (http://www.ifsc.usp.br/~hoyos/courses/2010/SLC0574/04-ResistenciaCorrenteEletrica.pdf), acesso em 24/9/2015.
INMETRO. Sistema internacional de unidades. Instituto Nacional de Metrologia, Qualidade e Tecnologia - INMETRO, Rio de Janeiro, RJ, 2012, 93p.
IUPAC. Grandezas, Unidades e Símbolos em Físico-Química - São Paulo, SP, Brasil, Editora da Sociedade Brasileira de Química, 1ª Edição, 2018. 272 p.
Norma SAE J403 - 201406. Chemical Compositions of SAE Carbon Steels. Revised 2014, USA, 11p.
IUPAC. Who we are. Disponível em (https://iupac.org/who-we-are/) , acesso em 19/8/2022
Norma ASTM B456-17. Standard Specification for Electrodeposited Catingas of Copper Plus Nickel Plus Chromium and Nickel Plus Chromium. Revised 2017, USA, 12p.
VOGEL, A. I. Análise química qualitativa. Rio de Janeiro, RJ, Ed. LTC, 5ª edição. p. 409-410, 1988.
UNESCO. Dmitri Mendeleev e a lei periódica dos elementos. Disponível em (https://es.unesco.org/courier/junio-1971/dmitri-mendeleev-y-ley-periodica-elementos) acesso em 19/8/2022.
WEINER, R. Analytische Undersuchungen im galvanischen Betrieb. Saulgau, Württemberg, Deutschland. Ed. Eugen G. Leuze Verlag. Ed.1968, 190p.
WILD, P.W. Modern analysis for electroplating. Teddington, Middleses, England, Ed. Finishing Publications Ltd., Second Edition, 1984, 364p.
ZOULIAS, E.; VARKARAKI, E. LYMBEROPOULOS, N.; et al. A review on water electrolysis. Centre for Renewable Energy Sources (CRES), Ed. Cyprus, Pikermi, Greece, disponível em (http://www.cres.gr/kape/publications/papers/dimosieyseis/ydrogen/A%20REVIEW%20ON%20WATER%20ELECTROLYSIS.pdf), acesso em 24/9/2015
*Pedro de Araújo é Consultor Galvanotécnico e Ambiental com 40 anos de experiência, professor, autor, pesquisador autônomo e inventor; pós-graduado latu-sensu em Auditoria e Perícia Ambiental – Unicesuma, Maringá-PR. Pós-graduado em MBA em Gestão Ambiental e Desenvolvimento Sustentável – Unicesumar, Maringá-PR. Tecnólogo em Gestão Ambiental – Unicesumar, Maringá-PR. Técnico Químico – ETECAP, Campinas-SP. Atualmente, comanda a PA8 Consultoria e Mentoria Galvanotécnica e Ambiental.














