
A conclusão de diferentes componentes utilizados para se realizar a deposição de metais por processos ‘electroless’ em uma superfície não condutora

Resumo
A eletrodeposição de camadas metálicas em uma superfície de plástica não-condutora é possível devido à deposição de uma fina camada de níquel metal, obtida sem o suporte de uma corrente elétrica externa. Trata-se do chamado níquel químico, ou níquel 'electroless'. Catalisado por um metal nobre, o banho desencadeia uma série de reações químicas, que culminam com a formação de uma camada fina, homogênea e condutora, permitindo a posterior eletrodeposição dos metais requeridos no processo (cobre ácido, níquel e cromo).
Abstract
An electroless metal deposition is typically used in a conductive surface for subsequent electroplating process, which is not really electroless, but uses an internal current source as described in this article. Basically, for plating on plastics applications, a solution which deposit nickel contains the metal in a presence of a reducer. Today, handling of the process is much easier in processes which requires high quality. Different kinds of stabilizers prevent such solutions from rapid or uncontrolled decomposition. While the thickness of the deposited metal is thin and just provides the necessary conductivity for subsequent electroplating, high speed systems are also available for functional applications. The thickness applied is enough to allow the subsequent plating of the metals required for the plating on plastics process.
Introdução
Uma superfície eletricamente não condutiva, como os materiais plásticos, por não apresentarem nenhuma condutividade, não podem receber diretamente a eletrodeposição de quaisquer metais, já que a aplicação de processos eletrolíticos com suporte de corrente elétrica não irá atuar na redução e deposição dos íons metálicos presentes no eletrólito. Tema largamente estudado, antigamente existiram muitas tentativas de superar esta limitação técnica e, mesmo nos dias atuais, ela segue sendo tema de relevância e objetivo de pesquisa e interesse por parte de fornecedores dessa tecnologia, com o intuito de melhorar a chamada ‘etapa sem eletricidade’ ou deposição ‘electroless’.
No início, se buscou a aplicação em material plástico contendo fibra de ferro, ou material preenchido com óxido cuproso (Cu2O), que foi reduzido a cobre para conferir condutividade; a aplicação de carbono como grafite; ou, ainda, a utilização de um polímero condutor contendo politiofeno, polianilina ou polipirrol. Todas essas ideias não tiveram êxito na tentativa de se revestir uma superfície plástica em geral. Entretanto, nos experimentos realizados, verificou-se que foi possível o preenchimento das pequenas lacunas nos orifícios de placas de circuito impresso, fazendo com que esses orifícios de passagem das placas de circuito impresso pudessem ser metalizados. Porém, peças plásticas de maior área, como chuveiros ou para-choques de automóveis, foram excluídas dos experimentos. Para tais finalidades, buscou-se a aplicação de uma primera camada condutora, que tivesse boa condutividade e fosse obtida a partir de um metal sólido, depositada sem a aplicação de corrente elétrica externa. Esse método, chamado de ‘deposição de metal sem corrente’ ou ‘deposição química de metal’, gera algumas discussões quanto à sua correta nomenclatura. O motivo é que a deposição não se dá sem corrente elétrica, e esta não é fornecida por uma fonte externa.
A ideia de uma ‘deposição de metal sem corrente’ é simples: uma solução que contenha íons metálicos e um agente redutor, terá os metais reduzidos, produzindo, assim, uma desejada deposição metálica. Entretanto, o emprego dessa consagrada técnica e processo comercial, bem verdade, fruto de uma ideia brilhante, leva em consideração diversos aspectos e percorre um longo caminho.
Em síntese, um agente redutor deve ser bastante forte e deve reagir imediatamente com o metal, e todos os íons metálicos serão instantaneamente reduzidos. Como resultado, todo o sistema se decompõe e produz uma espécie de lodo metálico.
A utilização de banhos depositados sem corrente elétrica externa com suficiente estabilidade e robustez, e que fornece uma ampla janela de operação, tem aplicação comercial na deposição de cobre químico e de níquel químico, que tipicamente emprega agentes redutores, tais como o hipofosfito. Entre outros exemplos, ideias bastante exóticas surgiram no passado, como a deposição de cobalto sem uso de corrente, a deposição química de níquel tendo hidrazina como agente redutor (a hidrazina é conhecida como um material com algum potencial cancerogenético) ou a partir da solução de dimetilsulfóxido (DMSO). Provavelmente, a mais antiga deposição sem uso de corrente elétrica externa é a deposição de prata em vidro para fabricação de espelhos.
Princípios da deposição de metal sem auxílio de uma corrente elétrica externa
Para a deposição do metal a partir de uma solução é necessária uma adequada e balanceada formulação, como a do agente redutor, que irá fazer com que os íons metálicos sejam reduzidos em um meio apropriado. Para permitir que os íons metálicos presentes na solução sejam mantidos, a presença de aditivos estabilizadores no sistema tem esse importante papel, além de atuar na regulagem e na velocidade da reação. Em geral, a reação de oxidação do redutor pode ser escrita como:

Durante a reação de oxidação são liberados dois elétrons e dois prótons que aumentam a acidez, portanto uma reação de neutralização é necessária:
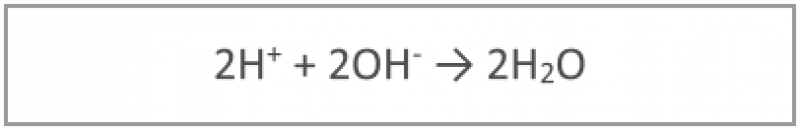
Como a reação de oxidação está em equilíbrio, o aumento do pH da solução normalmente altera a reação de oxidação/redução para o lado direito, na direção da oxidação, acelerando a reação, pois a velocidade depende da concentração dos componentes da reação. Em todos os eletrólitos, a deposição de metais sem corrente externa são geralmente meios alcalinos, ajustadas por agente tamponantes especiais.
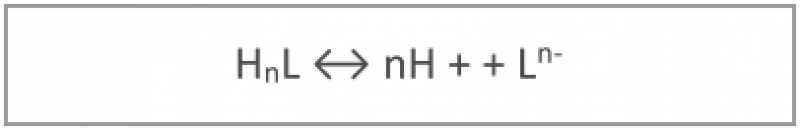
Em meios alcalinos, os íons de níquel não são solúveis. Logo, um quelante é necessário para promover suficiente solubilidade:

e a concentração do quelante muitas vezes também dependerá do valor do pH:
Logo, um banho que será depositado sem corrente elétrica externa, deve ser constituído por íons metálicos, um sistema quelante, um agente tamponante - que manterá o pH sob certas condições - e um agente redutor. A velocidade de deposição do metal tenderá a aumentar com o incremento do valor de pH, com o aumento da concentração do redutor, com o aumento da concentração dos íons metálicos e com o aumento da temperatura.
Mecanismo da deposição de níquel “electroless” (sem uso de uma corrente externa)
Os sistemas de deposição de níquel químico, em comparação com outros eletrólitos, tendo cobre como exemplo, é muito mais estável e de melhor manuseio e operação. A fonte de níquel usada leva um sal de níquel – embora no passado houvessem tentativas de se empregar o hipofosfito de níquel a fim de se reduzir a concentração de sais que inevitavelmente se acumulam no banho durante a operação (surpreendentemente, o hipofosfito de níquel é um sal estável), logo a escolha por um outro sal de níquel se mostrou mais equilibrado do ponto de vista técnico e econômico.
Embora muitos outros agentes redutores possam ser empregados, a utilização de hipofosfito de sódio como agente redutor é a opção mais adotada, devido ao manuseio, estabilidade e custo. Na realidade, não há na literatura muitas alternativas possíveis de serem adotadas devido ao potencial elétrico de deposição do níquel, e também pelo iniciador da reação de deposição (paládio) por um lado e do potencial fornecido pelo redutor, por outro. As principais variações entre banhos de níquel químico sem corrente externa variam em função do sistema quelante utilizado.
Nos últimos anos, o desenvolvimento de banhos de níquel químico completamente livres de amônia tornaram-se uma realidade. Processos robustos e estáveis foram desenvolvidos e adotados por empresas que desejaram ter uma operação livre da presença deste componente em sua operação.
Os aditivos estabilizadores estão no foco das empresas que tem como meta uma operação ambientamente correta. Nas primeiras aplicações de níquel químico, utilizam-se elementos químicos da família de metais pesados para esta finalidade. Hoje, as opções oferecidas ao mercado são tecnologias alternativas e 100% ambientalmente corretas.
A etapa de redução que ocorre é:
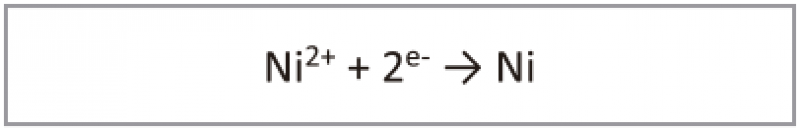
A oxidação do hipofosfito pode ser escrita como:

Em síntese, os íons de níquel reagem com o hipofosfito em pH alcalino para produzir níquel metálico e fosfito (também chamado de orto-fosfito).
Na primeira etapa da reação, o redutor adsorve em uma superfície metálica. Se o potencial for suficiente (para hipofosfito, no caso da superfície ser de níquel, ferro ou paládio, e não de cobre ou prata), ocorre a reação que pode ser considerada como a oxidação do hipofosfito: o redutor perde um átomo de hidrogênio e um elétron para a superfície. Forças eletrostáticas mantêm o produto da reação próximo à superfície até que água seja adicionada. Como resultado, ocorre a separação de um átomo de hidrogênio e de um elétron. Nesse instante, a molécula é capaz de deixar a superfície e dissolver-se no líquido: o hipofosfito foi oxidado em fosfito. Essa reação será repetida até que muitos elétrons sejam distribuídos no metal e até que sua carga negativa impeça uma nova reação. Durante esse processo, o potencial elétrico do metal se altera.
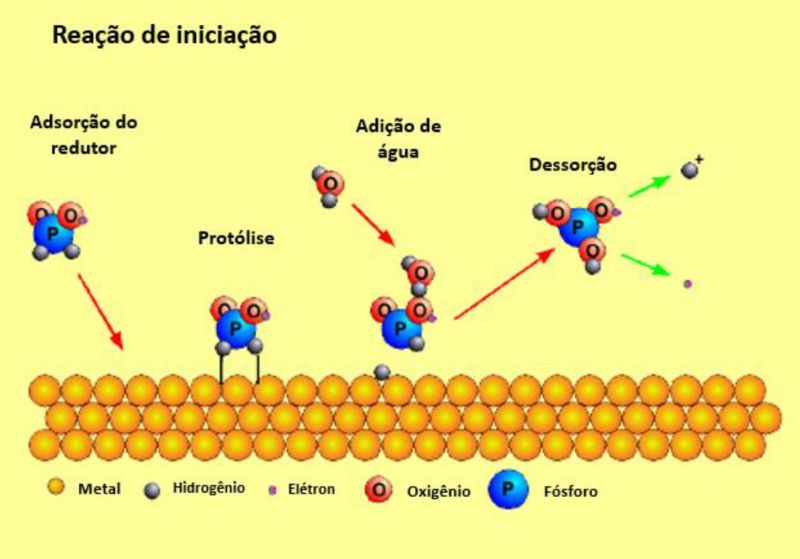
FIgura 1: Ilustração da reação superficial do hipofosfito.
Agora, a superfície carregada tem algumas possibilidades:
1. Os átomos de hidrogênio podem mover-se juntos, combinar e formar gás hidrogênio, que se separa da superfície. Essa reação lateral é observada toda vez ao mesmo tempo que o eletrólito trabalhar e depositar níquel haverá a evolução do gás hidrogênio, mas a quantidade despreendida de gás não está relacionada à quantidade de metal depositado.
2. O hidróxido na solução alcalina é reduzido a água por átomos de hidrogênio, e sua capacidade de redução infelizmente é perdida.
3. O hipofosfito é continuamente reduzido por átomos de hidrogênio formando água no final e provendo fósforo, que é incorporado na camada depositada de níquel químico.
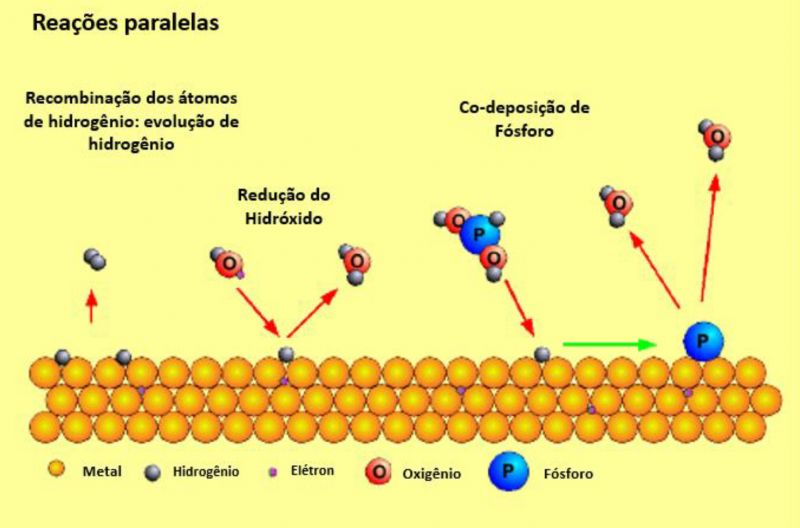
FIgura 2: Ilustração da reação superficial do hipofosfito
4. A principal reação que ocorre é a deposição de níquel. Os íons de níquel reagem com os átomos adsorvidos de hidrogênio na formação da camada de metal, enquanto os prótons ficam rodeados de água e estão distribuídos na solução. O pH do meio se torna ácido. A redução direta dos íons níquel a metal pelos elétrons no substrato representa menos de 1% da deposição total do metal.
Todas as reações secundárias produzem maior consumo de hipofosfito do que o necessário na redução dos íons níquel. De acordo com a literatura, sob circunstâncias práticas, aproximadamente, três moléculas de hipofosfito são necessárias para reduzir um íon de níquel. Se usarmos o peso molecular do níquel e do hipofosfito de sódio - 5,4 g deste último seriam necessários para reduzir 1,0 g de íons de níquel.
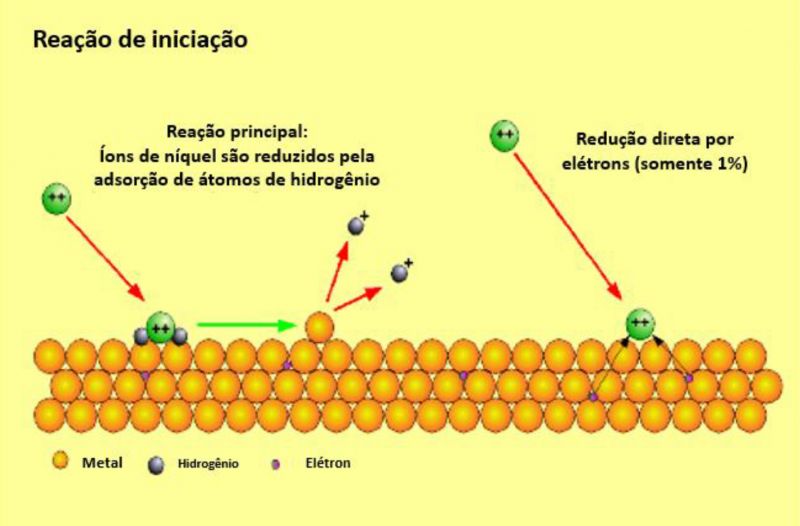
Figura 3: Reação principal de redução do níquel.
Conclusão
A deposição de metais por processos ‘electroless’ é mandatória no processo de eletrodeposição de uma superfície não condutora. A reação completa é bastante complexa e tem a influência de vários fatores. Em circunstâncias normais, a reação ocorrerá apenas em superfícies especiais e cataliticamente ativas. No processo de cromação de plásticos, o metal paládio é aquele utilizado para iniciar a deposição sem que haja emprego de corrente elétrica externa. O metal depositado cresce rapidamente ao redor do catalisador devido à sua elevada atividade catalítica. Dependendo do sistema utilizado, a velocidade de deposição pode então desacelerar a partir de determinado momento. Devido ao seu mecanismo de crescimento, quando comparado com a eletrodeposição, as camadas depositadas quimicamente são mais porosas e exibem uma estrutura granular.
Uma fina camada de níquel químico é suficiente em uma bem-sucedida aplicação no processo de cromação de peças plásticas. Geralmente, o tempo de imersão varia de 6 até 12 minutos e depende da exigência requerida.
A condutividade elétrica do níquel e do depósito de níquel-liga de fósforo obtido variam de acordo com a presença dos elementos depositados. Excelente condutor, quando comparado com o cobre, o níquel apresenta maior resistividade elétrica.
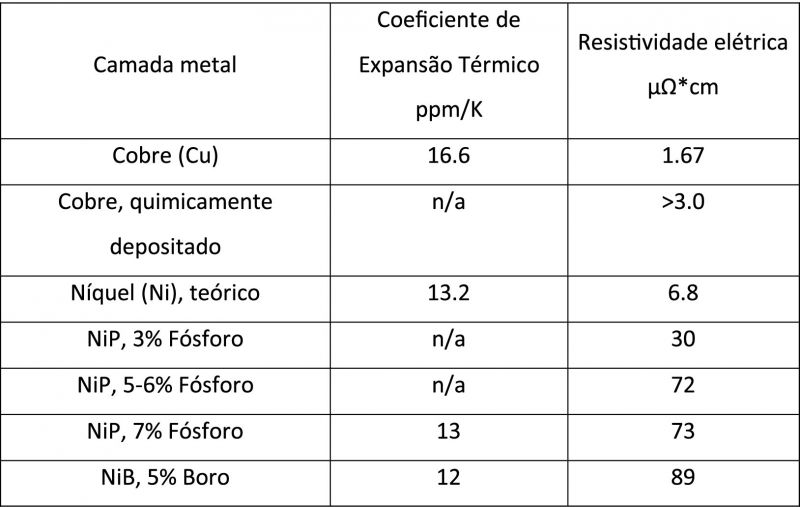
Em função dessa excepcional característica do metal cobre, podemos aplicar o chamado ‘cobre químico’ logo após o níquel químico com o intuito de potencializarmos a condutividade da superfície e, dessa forma, obtermos melhores resultados na deposição dos banhos eletrolíticos subsequentes. Na prática, procedemos à conversão da camada de níquel por cobre. A reação pode ser representada pela equação:
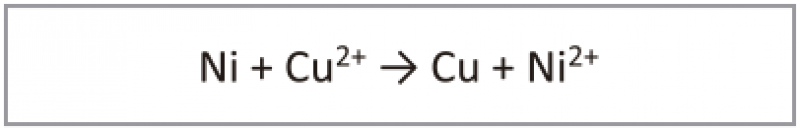
Para aplicações que exigem uma alta proteção contra corrosão, camadas de níquel químico bastante espessas são depositadas, atingindo espessuras de até 200 µm de níquel. Nesses casos, o metal é depositado em banhos operados em soluções especialmente formuladas, que trabalham a quente, e capazes de depositar mais de 20 µm/h. É uma liga contendo boro ou fósforo, e sua concentração oscila na faixa de 3% a 12% em peso.
Para um eletrólito de níquel químico utilizado na produção de peças plásticas, opera-se com uma concentração de 3 g/l de níquel de, aproximadamente, 15 g/l de hipofosfito. Após o consumo de 3 g/l de níquel (ou seja, 1 MTO ou 1 metal turnover), a concentração de fosfito aumenta em cerca de 30 g/l; com isso, a solução muda seu comportamento: a ductilidade do níquel depositado é alterada e a camada torna-se mais quebradiça. Além disso, a condutividade elétrica diminui. A evoução de gás hidrogênio aumenta e provoca redução na velocidade de deposição. Dessa forma, o banho tende a tornar-se menos estável e mais lento. Após a concentração de fosfito atingir valores elevados, a melhor alternativa é substituir a solução, pois essas mudanças fisico-químicas irão alterar a alta qualidade exigida no processo.
Referências
Metallizing of Plastic Substrates, R.Cassat (Rhone Poulenc), Patent US 4,590,115.
Progress in the Understanding of the Hypophosphite Oxidation on Nickel Single Crystals, L.M.Abrantes, M.C.Oliveira, Electrochim. Acta 41(10), 1703 (1996).
Modeling of Nickel Surface State in Electrocatalytic Hypophosphite Oxidation according to On-line Mass Spectroscopy Study, Z.Jusys, A.Vaskelis, Ber.Bunsenges. Phys.Chem. 101(12), 1865 (1997).
Catalytic Activity of Iron, Nickel and Nickel-Phosphorous in Electroless Nickel Plating, J.Flis, D.J.Duquette, J.Electochem. Soc. 131(1), 34 (1984).
Nucleation and Growth of Electroless Nickel Deposits on Molybdenum activated with Palladium, ibid 51 (1984).
The Mechanics of Electroless Nickel Deposition, S.F.Smith (Erieview Metal Trading Co), Metal Finishing, May 1979.
On the Mechanism of Electroless Nickel Phosphorous Plating, L.M.Abrantes, J.P.Correia, J.Electrochem. Soc. 141 (9), 2356 (1994).
In-situ UV-vis Spectroscopic Study of the Electrocatalytic Oxidation of Hypophosphite on a Nickel Electrode, Y.Zeng, S.Zhou, Electrochemistry Communications 1, 217 (1999).











