
Guia detalhado e completo de biocidas para você revolucionar o seu processo de pintura com o menor impacto ambiental possível

Doutor em Química pelo Instituto de Química da Universidade de São Paulo. Atualmente integra o grupo de Pesquisa e Desenvolvimento em tintas, da Axalta Coating Systems do Brasil, supervisionando o Laboratório E-coat da unidade de Guarulhos (SP).
Abstract
Microbiological contamination of the e-coat system is a threat to good operation of the coating process. This paper presents some basic definitions in microbiology, some sources of contamination, the test method to monitor the microbiological activity and propagation, some classes of biocides and their mechanisms of action. The consequences of high degrees of contamination as well as some practical rules for disinfection are also discussed.
Resumo
A contaminação microbiológica em um sistema e-coat é uma ameaça à boa operação do processo de pintura. Este artigo apresenta algumas definições básicas em microbiologia, algumas fontes de contaminação, o método de teste para monitorar a atividade e propagação microbiológica, algumas classes de biocidas e seus mecanismos de ação. As consequências de um alto nível de contaminação, bem como algumas regras práticas para a desinfecção, também são discutidas.
INTRODUÇÃO
A tinta de eletrodeposição (e-coat), assim como qualquer sistema de pintura à base de água, é suscetível à contaminação microbiológica. A classe de produtos químicos utilizada como aditivo para tinta, cuja finalidade é impedir ou retardar este processo, é denominada genericamente de microbicida ou, simplificadamente, biocida. A utilização de biocidas torna-se fundamental porque a presença de água, do carbono proveniente das resinas, e dos solventes, além de nutrientes inorgânicos provenientes das cargas minerais, levam a uma mistura apropriada para o desenvolvimento de uma grande variedade de micro-organismos (Contant et al., 2010).
Historicamente, gerações antigas de e-coat apresentavam uma maior resistência ao ataque, pois continham metais pesados na forma de pigmentos anticorrosivos – tais como cromato de chumbo – ou ainda compostos organometálicos de metais pesados, como o óxido de dibutil estanho (DBTO), que atuava como catalisador; apesar da toxicidade associada, apresentavam importante ação biocida. A evolução da legislação trabalhista e ambiental, gradativamente, baniu o chumbo e limitou o uso de estanho, o que – por tabela – tornou os banhos de eletrodeposição dependentes do monitoramento e controle microbiológico. As principais famílias de biocidas sintéticos (orgânicos) disponíveis no mercado representam um problema de ecotoxicidade menor do que os observados com metais pesados, mas, ainda assim, levam a acaloradas discussões sobre o uso; basicamente, temos um ‘mal necessário’ dada a importância crítica desses aditivos na preservação e utilização de tintas à base de água – das quais o e-coat faz parte.
Antes de prosseguirmos, é importante esclarecer alguns termos em microbiologia. Com base nos trabalhos da Fiocruz (2021) e de Glaser (2000), temos a maior parte das definições abaixo:
• Alga: Do latim ‘planta marinha’, representa um amplo grupo de organismos autotróficos (utilizam a luz como fonte de energia através da fotossíntese), podendo ser uni ou pluricelulares. A simbiose entre fungo e alga é conhecida por líquen ou, mais precisamente, fungo liquenizado.
• Bactérias: São organismos unicelulares, desprovidos de núcleo (procariontes), tendo o seu material genético, o DNA, de forma circular. Proliferam geralmente por fissão transversal binária. Possuem paredes rígidas e exibem três formas principais a saber: redondas ou cocos, em bastonete ou bacilos, e espiraladas ou espiroquetas.
• Biofilme: Comunidade estruturada e funcional de micro-organismos dispersa em matrizes poliméricas geradas pelos mesmos visando relações simbióticas (colaborativas) e permitindo a sobrevivência em ambientes hostis.
• Cepa: População de uma mesma espécie descendente de um único antepassado ou que tenha a mesma origem, conservada mediante uma série de passagens por hospedeiros ou subculturas adequadas.
• Fungos: Microrganismos eucarióticos (aqueles cujo núcleo celular é compartimentado/isolado por uma membrana) não-fototróficos (incapazes de utilizar a luz como fonte de energia). Qualquer vegetal do reino Fungi, destituído de clorofila, folhas, caule verdadeiro ou raízes. Podem ser uni ou multicelulares. O bolor, ou mofo, é uma designação comum dada a fungos filamentosos que não formam estruturas semelhantes a cogumelos. Ainda como fungos, temos as leveduras.
• Microbicidas: Substâncias químicas empregadas para matar micro-organismos. Dependendo de sua ação específica, pode ser denominado como bactericida, fungicida ou algicida - se atuar sobre bactérias, fungos ou algas, respectivamente.
• Micróbios: Termo genérico empregado para diversos micro-organismos distintos, tais como algas, bactérias e fungos.
Como acontece a contaminação de um banho e-coat?
Os micro-organismos possuem requisitos muito simples (pH, temperatura, fonte de nutrientes) para crescimento e proliferação, sendo que os intervalos ótimos desses fatores variam enormemente em função do seu tipo. Do ponto de vista prático, isto significa que a tinta – cedo ou tarde – será contaminada. Cabe ao formulador adotar a melhor estratégia de proteção ao material analisando o tipo de biocida e sua respectiva concentração de trabalho.
Na fase líquida, o e-coat pode ser contaminado através de diversas fontes, e o processo pode se desenvolver rapidamente – para se ter uma ideia, muitas bactérias são capazes de duplicar a cada 20 minutos. Em ambiente propício, em apenas 5 horas, uma amostra contendo 500 bactérias passa ao número assustador de 16 milhões! Diferentes configurações de engenharia do tanque também representam um fator importante no processo de ataque microbiológico.
Temos como fontes de contaminação:
• Ar: Localidades com muita poeira estão associadas a um alto potencial de contaminação. Um tanque onde há restrição ao fluxo de ar tende a ser menos suscetível ao ataque por esta rota.
• Água: a água obtida através de poços artesianos ou de outras fontes não tratadas (córregos, lagoas, etc.) representam uma grande ameaça se não passarem pelo processo adequado de descontaminação.
• Matérias-primas (pós ou líquidos): Cargas e pigmentos, especialmente os oriundos de fontes naturais, podem estar contaminados com esporos. Materiais líquidos, tais como emulsões de resinas e tensoativos são suscetíveis à degradação microbiológica e podem se tornar focos de contaminação. Há sempre preocupação - e controle - pelos fabricantes de tintas, para que esses materiais não sejam fatores críticos ao processo de pintura.
• Recipientes: Devem ser entendidos de forma ampla, desde os tambores no qual o fabricante entrega a resina/pasta até os tanques nos quais o cliente possa armazenar seus materiais ou realizar a operação de pré-mistura de resina e pasta (tanque de pré-mix).
• Baixo nível de higiene das instalações: Talvez aqui resida a fonte mais recorrente de contaminação dos tanques. Resíduos de tintas ‘esquecidos’ nos tanques de pré-mistura, mangueiras de abastecimento, repletas de incrustações de materiais secos e abandonadas no chão de fábrica, são um grande convite à infecção. A área produtiva deve ser tão limpa quanto possível - não raro vemos problemas de higiene associados a seres vivos muito maiores, como baratas e ratos.
Considerando a engenharia do sistema de pintura, talvez o problema mais recorrente esteja associado à linha de água. Muitas vezes, após o tratamento da água bruta (via deionizadores ou sistemas de osmose reversa), a água é enviada para tanques sem abertura ou acesso conveniente para limpeza interna periódica. O uso de lâmpadas de ultravioleta muito além da vida útil recomendada pelos fabricantes ou, ainda pior, sua não previsão no projeto original contribuem para que toda a linha seja periodicamente comprometida.
Como detectamos a presença de micro-organismos no banho?
Há uma série de indícios que podem ser observados no tanque quando a contaminação microbiológica atinge níveis críticos. A ideia, entretanto, é impedir que a operação do tanque e a qualidade das peças pintadas sejam comprometidas antes que cheguemos a esse ponto; para este fim, existem os conjuntos (kits) para coleta e análise microbiológica em campo.

A Figura 1 ilustra um exemplo de conjunto comercial: uma lâmina plástica que possui dois meios de cultivo; a saber: extrato de malte ágar – para enumeração de fungos e leveduras –; e triptona soja ágar (TSA) – para enumeração de bactérias. A lâmina é mantida sempre dentro de um tubo lacrado, e todo o conjunto é previamente esterilizado pelo fabricante. Outros modelos comerciais, com diferentes meios de cultivo, podem ser solicitados conforme orientação do fabricante da tinta.
Basicamente, abre-se o conjunto, retirando-se a lâmina de dentro do tubo. Os meios de cultura contidos na lâmina são, então, imersos completamente na amostra para avaliação (água deionizada, água de enxágue do processo, banho de e-coat); feita a imersão por cerca de 20 segundos, escorre-se o excedente de material e retorna-se a lâmina ao tubo, sendo o conjunto novamente fechado. Após a etapa de coleta, o conjunto é colocado na posição vertical em estufa por tempo e temperatura pré-definidos (usualmente 72 horas a 36°C); este é o chamado período de incubação onde, ao final, serão observadas as unidades formadoras de colônias (u.f.c.). Através de inspeção visual com uma série de padrões é possível determinar se a amostra estava contaminada e seu respectivo nível de contaminação. Resultados iguais ou superiores a 103 u.f.c. para bactérias (um valor de referência), ou a confirmação da presença de bolores, demandam desinfecção imediata Infelizmente, esses meios de cultura não são universais (aplicáveis a quaisquer micro-organismos) e a possibilidade de um falso negativo jamais deve ser desconsiderada. Em linhas de pintura com bons controles de processo, a desinfecção atinge uma periodicidade quase que regular, variando de seis meses a um ano na maior parte dos casos.
Para varredura da linha, os seguintes pontos de coleta devem ser considerados: tanque de solução anolítica; tanque de e-coat; tanque de permeado; permeados recirculados e último enxágue do estágio de pré-tratamento (aquele que antecede ao tanque de tinta). A frequência de verificação deve ser ajustada em função do histórico da linha; na falta deste, deve-se iniciar a rotina com inspeções mensais. Alguns cuidados são fundamentais para evitarmos um falso positivo – que levaria a custos desnecessários com desinfecções – podemos citar:
- Utilizar luva descartável para evitar contaminação indevida no momento de coleta de amostra, esterilizando-a com álcool etílico antes do início da operação;
- Retirar a lâmina do tubo somente no instante da coleta de amostra;
- Proteger o laminocultivo de contaminação não intencional por saliva ou do vapor d’água exalado durante a respiração; em outras palavras, não fale e não aproxime o laminocultivo do rosto durante o processo de amostragem!;
- Jamais tocar o laminocultivo, mesmo que com luvas;
- Se o ponto de amostragem for através de um dreno, assegure-se de ter realizado uma purga com quantidade abundante de material para lavar a válvula e a tubulação do dreno em si antes de coletar a amostra;
- Um copo de plástico descartável limpo é suficiente para coletar a amostra; após purga do dreno, basta encher e esvaziar o copo algumas vezes com a amostra desejada para remover quaisquer resquícios que tenham chance de comprometer a amostragem. Lembre-se de que o copo é descartável - para cada amostra, um copo diferente.
Informações sobre as espécies que podem contaminar um banho de e-coat são escassas na literatura. Normalmente são citadas apenas espécies de tintas à base de água em geral. Downey (1995) fez alguns apontamentos nos quais podemos destacar: Micrococcus luteus (bactéria), Geotrichum candidum (fungo) e Candida albicans (levedura). Um trabalho recente, brasileiro, talvez seja a única informação disponível para nossa realidade: Sutti et al. (2020) identificaram a cepa de Staphylococcus warneri em um tanque de água de um aplicador de e-coat localizado no ABC paulista.
Considerações gerais sobre microbicidas comercialmente disponíveis
Os primeiros microbicidas para tintas eram à base de metais pesados e ofereciam um amplo espectro de atividade. O alto nível de toxicidade os tornava ambientalmente inaceitáveis; além disso, possuíam um tempo de atividade muito curto. O mercado evoluiu e novas alternativas não metálicas (sistemas essencialmente orgânicos) foram disponibilizadas. Como toda forma de progresso, novas limitações surgiram, pois, apesar da menor toxicidade, o custo do microbicida aumentou e o espectro de atuação foi reduzido. Conforme Downey (1995), os microbicidas podem ser divididos em dois grandes grupos quanto ao alvo de proteção:
- Os microbicidas para a tinta líquida (tipo ‘in can’), cuja função é conservar a tinta em condições de armazenamento - incluindo-se aqui o tanque de e-coat - até o momento de sua aplicação; e
- Os microbicidas para o filme de tinta aplicado e curado, os quais devem apresentar proteção ao ataque microbiológico após a pintura do substrato.
O primeiro tipo (i) é crítico para o e-coat e será objeto de discussão neste artigo; o segundo (ii), por sua vez, tem grande importância para as tintas de acabamento notadamente para os segmentos imobiliário, de madeiras ou marítimo. Mas o que um formulador deve buscar em um microbicida para tinta e-coat?
A literatura não é específica para esse caso, mas podemos fazer alguns apontamentos essenciais:
- Amplo espectro de atividade, devendo o produto ser compatível com os micro-organismos associados ao processo de degradação do material;
- Apresentar boa relação custo/benefício nas dosagens de trabalho;
- Apresentar rápida ação de desinfecção;
- Alta solubilidade em água e alta compatibilidade com o banho;
- Baixo odor;
- Baixa toxicidade;
- Estável nas faixas de pH e temperatura de operação do banho.
Quando pensamos na relação custo/benefício e na toxicidade da mistura final, certamente, consideraremos que o melhor é utilizar a menor quantidade possível de biocida. Mas como determinarmos esse valor? O cliente sempre será informado pelo fabricante da tinta sobre o tipo de microbicida e a faixa de concentração que o mesmo deve ser adicionado ao banho, sendo que a quantidade será dependente do nível de comprometimento do tanque. Para o formulador, normas como a ASTM D 2574-16 (ASTM 2020) podem servir de base para a definição de um método próprio para a escolha do biocida e de sua respectiva faixa de trabalho.
Conhecendo alguns microbicidas empregados em tintas e-coat
Segundo Glaser (2000), há duas categorias principais de ação para os microbicidas: a) substâncias com atividade na membrana do micro-organismo, e b) substâncias eletrofilicamente ativas.
No primeiro caso (a), o microbicida pode comprometer a semipermeabilidade da membrana, interferindo diretamente nos mecanismos de transporte de íons e moléculas; além de interferir na função de proteínas; e inibir a síntese de ATP (adenosina trifosfato – uma molécula que fornece energia para a execução de funções vitais no micro-organismo). Representantes típicos desta categoria são os compostos de amônio quaternários, ácidos, álcoois e guanidinas.
No segundo caso (b), as substâncias podem reagir com grupos funcionais nucleofílicos ou no bloqueio de aminoácidos e enzimas. Nesta categoria, temos os aldeídos e compostos liberadores de aldeídos, substâncias com halogênio ativo, isotiazolinonas e compostos organometálicos. O autor ainda afirma que “algumas moléculas não podem ser claramente atribuídas a uma destas duas categorias uma vez que, devido à sua estrutura, podem apresentar diversos modos de atividade”.
Representando o primeiro modo de ação (atividade na membrana) temos o Bronopol. O 2-bromo-2-nitro-1,3-propanodiol (CAS 52-51-7) é um microbicida de amplo emprego no mercado. Originalmente um sólido branco, é comercializado em amostras líquidas de coloração amarelada ao quelar com íons-ferro durante o processo de produção. Segundo Bryce et al. (1978), o Bronopol forma pontes de dissulfeto a partir de grupos tióis e essas ligações podem responder pela inibição da desidrogenase (um tipo de enzima) pelo composto. A inibição dessas desidrogenases, ligadas à membrana do micro-organismo, pode causar alterações na estrutura da membrana e levar à ruptura celular observada no tratamento com este biocida. A Figura 2 apresenta a estrutura química do Bronopol.
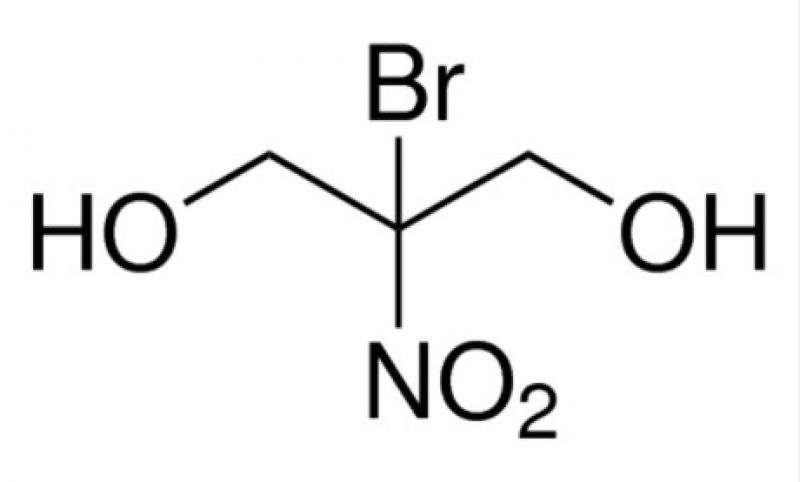
Figura 2: Estrutura química do Bronopol, ou 2-bromo-2-nitro-1,3-propanodiol (número CAS 52-51-7).
O segundo modo de ação (substância eletrofilicamente ativa) pode ser representada pela isotiazolinona e seus derivados: ainda segundo Glaser (2000), a ação microbicida está baseada na ligação N-S no anel. Ao reagir com componentes celulares nucleofílicos (aminoácidos, proteínas, enzimas), o anel é aberto e a ação microbicida é produzida. A substância ativa é consumida irreversivelmente. Uma vez que a ação depende da abertura do anel, quanto maior a estabilidade do composto menor sua efetividade microbicida. Os principais componentes desta família são o 2-metil-4-isotiazolin-3-ona (MIT), cujo número CAS é 2682-20-4, e o 5-cloro-2-metil-4-isotiazolin-3-ona (CMIT), número CAS 26172-55-4, sendo este último mais reativo que o primeiro por causa de seu átomo de cloro ativado pela ligação vinílica, o que configura dois grupos toxicofóricos (subunidade da estrutura responsável pela resposta tóxica) em uma única molécula. O CMIT, infelizmente, não possui grande estabilidade a uma série de fatores, tais como agentes redutores ou oxidantes, aminas, e temperaturas superiores a 40°C. Íons bivalentes como Cu2+, Mg2+ e Ca2+ são adicionados ao biocida para estabilizá-lo e protegê-lo de ataques nucleofílicos fora da célula microbiana. A Figura 3 apresenta as estruturas químicas do MIT e do CMIT.
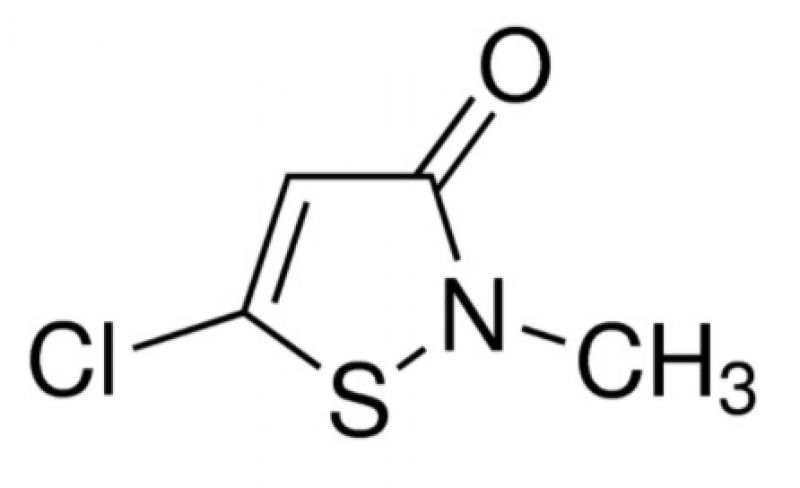
Figura 3: Estruturas químicas do 2-metil-4-isotiazolin-3-ona (MIT, à esquerda) e do 5-cloro-2-metil-4-isotiazolin-3-ona (CMIT, à direita).
Cabe aqui destacarmos ao menos um biocida inorgânico. Sem sombra de dúvidas, o nitrato de prata é o mais conhecido para atividades no próprio tanque. É um material de amplo espectro, podendo ser utilizado inclusive nos sistemas anolíticos, onde os biocidas orgânicos não se fazem adequados por serem capazes de degradar quimicamente os eletrodos. Por apresentar alto custo, é empregado apenas para os referidos sistemas anolíticos ou em casos no qual não se deseja variação significativa do pH do banho ou estágios de enxágue – os dois biocidas discutidos anteriormente, por exemplo, são comercializados em soluções de caráter fortemente ácido. Segundo Li et al. (2018), os íons prata são altamente tóxicos para todos os micro-organismos. Íons Ag+ afetam a função de enzimas ligadas à membrana celular, tais como as envolvidas na cadeia respiratória; também foi demonstrado que, após o tratamento com Ag+, o DNA perde sua habilidade de replicação e as proteínas se tornam inativas. A ação antimicrobiana do íon Ag+ está intimamente relacionada pela sua interação com grupos tióis em enzimas e proteínas. Ainda, segundo este autor, trabalhos recentes mostram que íons Ag+ promovem a geração de espécies reativas de oxigênio, os quais levam a um efeito antibacteriano aumentado, uma vez que estas espécies são oxidantes altamente tóxicos capazes de danificar proteínas, DNA, RNA e lipídios do micro-organismo.
Contaminação do banho e-coat: consequências e recomendações gerais para desinfecção
Um banho de e-coat com níveis acentuados de contaminação microbiológica apresentará uma série de comportamentos atípicos, dentro os quais podemos destacar:
- Perda da estabilidade histórica do pH do banho, passando a aumentar (ou, em casos mais raros, a diminuir) de forma consistente, colocando em risco a estabilidade do banho se o mesmo ultrapassar valores de 6,5;
- Forte odor característico, às vezes pútrido;
- Perda de aspecto (‘enrugamento’) do filme depositado;
- Irregularidade da camada da tinta eletrodepositada, normalmente associada com problemas de transferência de corrente elétrica para a tinta;
- Deterioração do banho. A Figura 4 ilustra o impacto no aspecto de uma pintura e-coat obtida a partir de um banho comprometido. Os produtos do metabolismo bacteriano também podem representar uma ameaça ao tanque: alcóxi-ácidos, como o ácido butoxiacético (“BAA”), desestabilizam o banho aumentando o nível de sedimentos (processo de ‘kick out’). O material sedimentado apresentará um maior teor de dióxido de titânio (pigmento branco) e de silicatos de alumínio. Infelizmente, os alcóxi-ácidos não são permeáveis ao sistema de ultrafiltração e só serão removidos via arraste pela peça pintada (‘coat out’). O BAA é o produto obtido a partir do butil glicol (butil cellosolve) via metabolismo bacteriano.

Figura 4: Impacto no aspecto de uma pintura e-coat obtida a partir de um banho comprometido. À esquerda: pintura a partir de banho de referência; à direita: pintura de banho com elevado nível de contaminação microbiológica nas mesmas condições de aplicação, camada e cura utilizadas no banho de referência.
Focando no processo de pintura e seus equipamentos, as seguintes observações podem ser indícios de contaminação:
- Comprometimento (e, eventualmente, perda) da membrana da célula de diálise;
- Redução do volume de ultrafiltrado gerado e, em casos extremos, perda da membrana de ultrafiltração;
- Redução das vazões nas células de diálise causada por entupimento das conexões e tubulações;
- Perda de eficiência no processo de lavagem. Entupimentos e perdas de vazões são causados pelo crescimento de biofilme, o qual se torna uma barreira física à livre passagem dos fluidos, sendo quase impossível de removê-lo dos interstícios das membranas de diálise ou ultrafiltração. A Figura 5 demonstra resíduos de um biofilme retirado das paredes de um tanque de armazenamento de ultrafiltrado puro.

Figura 5: Resíduos de um biofilme retirado das paredes de um tanque de armazenamento de ultrafiltrado puro. À esquerda: visão geral de uma das paredes; à direita: raspas contendo o biofilme.
Uma vez caracterizada a contaminação, deve-se proceder à desinfecção do tanque e/ou das partes do sistema que foram comprometidas. A dosagem do biocida dependerá do tipo escolhido, da concentração do ativo e do nível de contaminação do sistema. Neste momento, é fundamental seguir às instruções de dosagem apontadas pelo fornecedor do e-coat. Em linhas gerais, os seguintes cuidados auxiliarão em uma desinfecção segura do sistema:
- Atenção ao pH do biocida! Muitos biocidas orgânicos para e-coat são fornecidos em soluções fortemente ácidas. A adição direta ao tanque de tinta pode levar à desestabilização do banho, formando grumos que poderão comprometer o aspecto da pintura e levar ao entupimento dos filtros. É importante adicionar o biocida no último estágio de enxágue que permita o transbordo (‘cascateamento’) deste produto em direção ao tanque de e-coat. Adicione os materiais fortemente ácidos a uma baixa velocidade (cerca de 40 litros/hora);
- Materiais em pó, como o nitrato de prata, devem ser pré-diluídos em água deionizada; para o sal em questão, dilua-o a uma concentração final de 12 g/L;
- O sistema anolítico é normalmente atacado por mofos da espécie Paecilomyces variotii, muitas vezes chamado de ‘Mãe do Vinagre’ (Mother of Vinegar), o que gera certa confusão quando se verifica que a Mãe do Vinagre ‘original’ vem da bactéria (e não do mofo) Acetobacter aceti, empregada para se obter vinagre a partir de vinho, cidra ou outros líquidos alcoólicos. O termo, portanto, deve ser evitado. Alheio ao nome, a identificação do mofo pode ser feita com o uso de um holofote/lanterna para inspecionar as paredes e o fundo do tanque de estocagem de anolito. Eles são como bolas de algodão translúcidas que cobrem as paredes e proteções das bombas do sistema. Quando presentes, atacam os revestimentos do tanque de estocagem de anolito, tubulações, bombas e células de diálise. Infelizmente, conjuntos para incubação deste tipo de mofo não estão comercialmente disponíveis. O sistema anolítico não deve ser tratado com biocidas contendo cloretos. Lembra-se de que isotiazolinona e seus derivados não são muito estáveis e necessitam de sais de íons bivalentes para conservá-los de forma adequada? Estas soluções podem conter cloretos; estes íons, dado o pequeno raio iônico, são capazes de ultrapassar a camada cromada do eletrodo e causar forte corrosão por pites (pitting) nos ânodos de aço inoxidável. O nitrato de prata é uma boa opção pois é compatível com banhos e-coat – outros materiais, como o peróxido de hidrogênio, apesar de mais baratos, podem representar um perigo desnecessário ao tanque caso haja algum vazamento durante o processo de desinfecção. Muitas vezes, observam-se barras de cobre inseridas no reservatório de anolito: a solução anolítica ácida deveria causar lenta corrosão desta barra e liberar íons Cu2+, de efeito microbicida. Na prática, porém, não se observa maior resistência ao ataque microbiológico, talvez porque o volume de descarte do anolito, e a reposição com água deionizada, seja alto o bastante para impedir que o cobre atinja a concentração mínima para atuar como microbicida.
- Biocidas são materiais de contato. É preciso certo tempo de interação para que o efeito desejado seja obtido. Assim, tempos de recirculação de um dia (24 horas) são comuns para desinfecção eficiente do sistema.
- A presença de íons Fe3+ é um problema para o uso de alguns microbicidas, pois atua como um gatilho para a degradação do CMIT e MIT, tornando o tratamento ineficiente. Este íon pode fazer com que estes microbicidas não cumpram mais sua função original após 2-3 dias. Íons Fe3+ podem chegar ao tanque:
a) Através do arraste (“carry over”) do pré-tratamento ao banho;
b) Pela dissolução do ânodo e mistura ao banho, se houver algum vazamento na membrana da célula de diálise, ou
c) Através da dissolução de partes do tanque que não se encontram devidamente protegidos pelo revestimento isolante.
- A checagem de lâmpadas de ultravioleta, normalmente empregadas em reservatórios de água deionizada, deve ser realizada uma vez ao dia. Respeitar o número de horas de operação da lâmpada é mandatório para assegurar a qualidade da água de entrada. A limpeza do reservatório pode ser efetuada com hipoclorito ou peróxido de hidrogênio; todavia, o enxágue deve ser rigoroso para assegurar que os materiais de desinfecção não cheguem ao tanque.
Conclusões
A eliminação de metais pesados em tintas de eletrodeposição tornou o sistema mais suscetível ao ataque microbiológico. Graças aos microbicidas modernos, podemos superar este obstáculo de forma segura e com o menor impacto ambiental possível. Conhecer esses materiais, portanto, é o primeiro passo para o gerenciamento correto de um tanque de e-coat. Através deste trabalho, o autor espera ter disseminado conceitos e práticas que ajudem aos profissionais da área na execução de atividades relacionadas ao processo de monitoramento e desinfecção de sistemas comprometidos por ataques de micro-organismos.
Agradecimentos
O autor agradece aos profissionais Elmer Livio Jurado Ruales, Marcos Andrade da Silva e Viviane Santos Souza pela revisão técnica do artigo.
Referências Bibliográficas
ASTM D2574-16 (2020)e1, Standard Test Method for Resistance of Emulsion Paints in the Container to Attack by Microorganisms, ASTM International, West Conshohocken, PA, 2020.
Bryce, D.M., Croshaw, B., Hall, J.E., Holland, V.R., The activity and safety of the antimicrobial agent Bronopol (2-bromo-2-nitropropan-1,3-diol), Journal of the Society of Cosmetic Chemists, Vol. 29, No. 01, p. 3-24, 1978.
Contant, S., Caritá Júnior, G., Machado, P.F.M.P.B., Lona, L.M.F., Evaluation of the effect of dry-film biocides on paint film preservation using neural networks, Brazilian Journal of Chemical Engineering, Vol. 27, No. 04, p. 643 - 651, October - December, 2010.
Downey, A., The use of biocides in paint preservation. In: Rossmoore, H.W. (Ed.), Handbook of Biocide and Preservative Use, Springer Science + Business Media Dordrecht, 1995, p. 254 – 282.
Fiocruz. Página da Fundação Oswaldo Cruz disponível em http://www.fiocruz.br/biosseguranca/Bis/glossario/Glossario.htm. Acesso em 11/02/2021.
Glaser, J.K., Biocides. In: Bielemen, J., Additives for Coatings, Wiley-VCH Verlag GmbH, 2000, p. 306 – 324.
Li, W., Calle, L.M., Hanford, A.J., Stambaugh I., Callahan, M.R., Investigation of silver biocide as a disinfection technology for spacecraft – an early literature review, 48th International Conference on Environmental Systems, 8 -12 July 2018, Albuquerque, New Mexico.
Sutti, D.R.O., Kunigk, L., Jurkiewicz, C., Izothialozolone base biocides: efficiency evaluation on Staphylococcus warneri isolated from e-coat process rinse water, Journal of Bioenergy and Food Science, 7(2), 2020. DOI: 10.18067/jbfs.v7i2.278.













