

Pedro de Araújo 1
Osmar Ailton Alves da Cunha 2 e José Katz 3
1,3 EFIL Equipamentos para Filtração Ltda. - Divisão GALVANO, R. Dr. Alcides de Campos, 225 - São Paulo, CEP 04336-160 - SP-Brasil, (11) 5679-0033, efil@uol.com.br; pdearaujo64@g.mail.com
2 Rohm and Haas Química Ltda. –, Av. Nações Unidas, 12551- 13°A- São Paulo-SP-Brasil, CEP 04578-903 Fone: (11) 5112-9056, ocunha@rohmhaas.com
Publicado na edição 148, página 26 da Revista TS - REV 5-20/05/21 – Pedro de Araújo para Portal TS
Introdução
Cianeto, também chamado em nomenclatura hoje obsoleta, de cianureto, é a denominação genérica e incorreta dada a qualquer composto químico que contém o grupo ciano C≡N, com uma ligação tripla entre o átomo de carbono e o de nitrogênio.
Os compostos orgânicos que possuem este radical são denominados nitrilas.
Os compostos inorgânicos que contém o ânion (CN-) derivados do cianeto de hidrogênio ou ácido cianídrico (HCN) são chamados cianetos e sua forma comercial mais comum é combinada com os cátions potássio (K+) e sódio (Na+), respectivamente formando as substâncias cianeto de potássio (KCN) e cianeto de sódio (NaCN).
Estes sais derivados do ácido cianídrico, quando estiverem presentes em uma solução aquosa de pH < 12, veja o gráfico 1, devido à sua grande facilidade de hidrolisar, formam ácido cianídrico (HCN) resultando em um meio altamente tóxico que poderá liberar o referido gás cianídrico, letal em pequenas concentrações principalmente se na solução cianídrica houver a condição de pressão e temperatura: 100KPa a 26°C.
O equilíbrio da reação CN- + H+ « HCN(aq.) ocorre em pH 9,3.
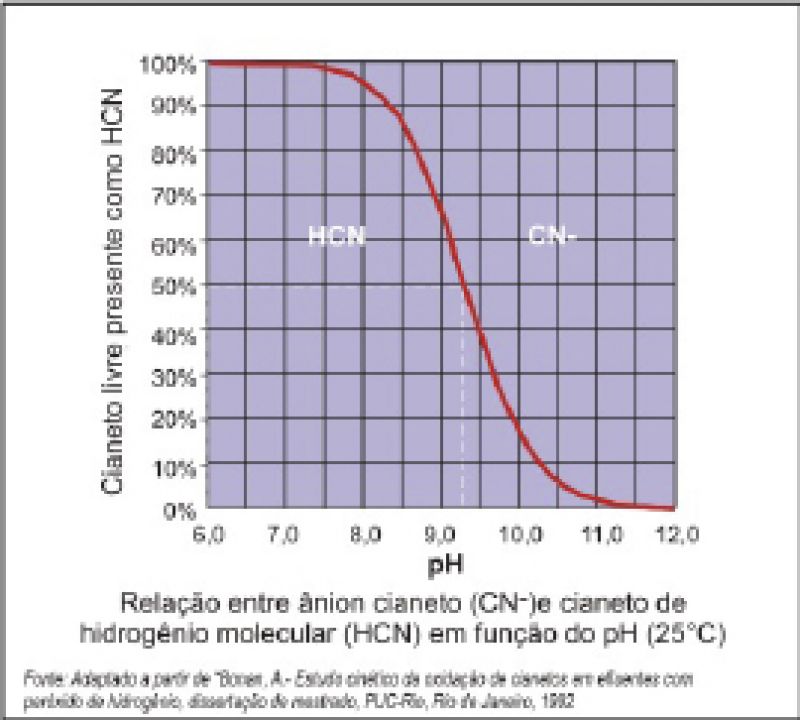
Gráfico 1
O cianeto de hidrogênio é um gás incolor extremamente tóxico, considerado um dos venenos mais letais conhecidos pelo homem. Fórmula molecular: C-H-N. Peso molecular: 27,03g. À temperatura ambiente, é extremamente volátil. A sua temperatura de fusão é de –13,4 ºC, e a temperatura de ebulição é de 25,6 ºC. É solúvel em água, álcool e éter, facilmente inflamável. Possui um típico odor semelhante ao cheiro de amêndoas amargas. Pode ser produzido pela reação de um cianeto (sal) com um ácido forte ou pela reação da amônia com monóxido de carbono.
Os sais dos cianetos de sódio e potássio são sólidos brancos deliqüescentes, solúveis em água, amônia solução, e levemente solúveis em álcool. Usar o olfato e o paladar para identificar um dos venenos é erro fatal.
A toxicidade do íon cianeto (CN-)é conhecida há mais de dois séculos; porém, os compostos que contém cianeto são tóxicos somente se liberarem HCN numa reação.
A ação tóxica do HCN deve-se à sua capacidade de inibir a enzima citocromo oxidase mitocondrial, fundamental no transporte de elétrons para as células consumirem o gás oxigênio transportado pelo sangue. O íon cianeto provoca a parada da respiração celular. A pessoa envenenada acaba morrendo por asfixia, mesmo que o seu sangue esteja saturado de oxigênio. As células morrem e esse processo acontece rapidamente nos centros vitais do organismo provocando óbito.
Por ingestão, a dose capaz de provocar a morte é de 1 mg por quilograma de massa corpórea. Por inalação, uma concentração de 0,3 mg por litro de ar mata entre 3 e 4 minutos.
Quando o sal cianídrico atinge o estômago, reage com o ácido clorídrico presente no suco gástrico: NaCN(s) + HCl(aq) ® HCN(g) + NaCl(aq)
Alguns açúcares, como a glicose e a sacarose, se combinam com o cianeto, formando uma substância praticamente sem toxicidade, denominada cianidrina.
O tratamento deve ser aplicado de imediato, sem perda de tempo. Em casos de absorção de grandes quantidades desse ácido, é inútil aplicar algum tratamento que, quando possível, consiste em injeções de soluções aquosas e nitrito de sódio e/ou tiossulfato de sódio. Antigamente, utilizavam-se também injeções de soluções aquosas de azul de metileno.
Nos processos industriais de mineração os cianetos inorgânicos, devido à estabilidade dos complexos formados, são importantes para extração de ouro e prata, em metalurgia tem destaque nos processos de tratamento térmico, em agricultura como inseticida, em fotografia presente nos reveladores, em sínteses orgânicas têm seu lugar de destaque em vários processos como na produção da acrilonitrila (cianeto de vinila) produto muito importante na manufatura de tecidos sintéticos e colas instantâneas. Em galvanoplastia são largamente utilizados nas várias formas de sais alcalinos contendo principalmente sódio, potássio, zinco, cobre, cádmio, ouro, prata, níquel, bário, dentre outros. O gráfico 2 mostra os principais usos do cianeto.
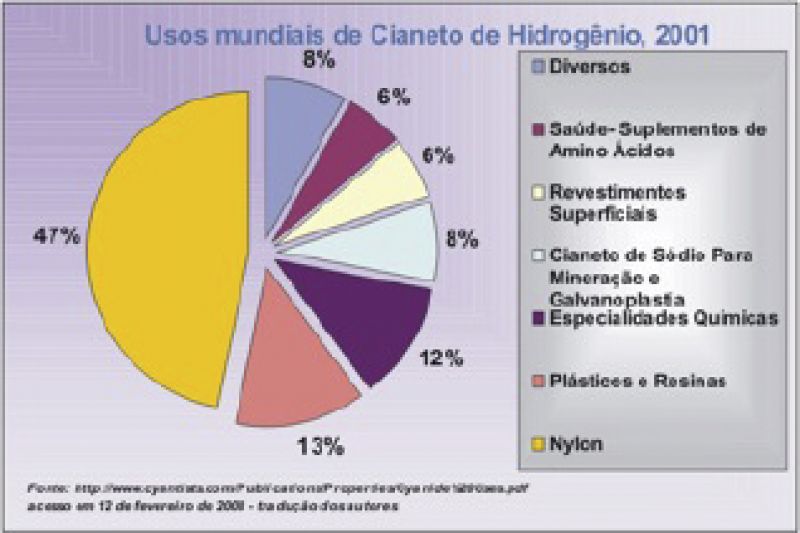
Gráfico 2
Na natureza o cianeto é encontrado em diversas plantas, como nas sementes lenhosas de algumas frutas e numa variedade da mandioca, vulgarmente chamada de mandioca-brava: uma planta encontrada no continente sul-americano altamente tóxica quando in natura, mas sua raiz é muito consumida e apreciada na forma de farinha torrada, após a destruição do cianeto.
Cianetos presentes em efluentes de processos industriais são altamente tóxicos para mananciais de superfície e subterrâneos sendo necessária sua remoção do meio por alguma técnica específica, das quais falaremos mais adiante.
O limite permitido do cianeto total presente em um efluente industrial quando do seu lançamento em rede receptora ou manancial, conforme a legislação federal, Resolução Conama n° 357, art. 34, é de 0,2mg/L.
Envenenamento por Cianeto
Dada a importância do cianeto e seu uso em galvanoplastia, inserimos neste trabalho, com a devida autorização, parte do texto publicado no endereço http://www.ff.up.pt/toxicologia/monografias/ano0304/Cianetos/index.htm de autoria de Dr. Ana Isabel Pimentel Neves, Dr. Joana Gonçalves de Ascenção e do Prof. Doutor Fernando Remião do Laboratório de Toxicologia da Faculdade de Farmácia da Universidade do Porto, Portugal, que demonstra como ocorre o envenenamento por cianeto. Veja a seguir como isso acontece:
Grafia original:... “Toxicologia e Fisiopatologia: O cianeto é absorvido rapidamente pelo tracto respiratório quando inalado sob a forma de HCN e mais lentamente pelo tracto gastrointestinal quando da ingestão de sais de cianeto (sais de sódio e potássio) e glicosídeos cianogénicos (amigdalósido e linamarósido, por exemplo); o envenenamento por contacto da pele com soluções concentradas de cianeto de sódio e de potássio também pode ocorrer, sendo a absorção mais lenta que a observada pela inalação. O cianeto, uma vez absorvido, distribui-se rapidamente pelos glóbulos vermelhos e pelos tecidos. A desintoxicação ocorre através da combinação do cianeto com o enxofre (S) para formar tiocianato. Esta combinação pode ocorrer por duas vias: enzimaticamente através de reacções catalisadas pela rodanase ou por uma segunda via, esta não enzimática, por combinação com a albumina. O tiocianato, composto menos tóxico, é eliminado por via renal tendo um tempo de semi-vida de eliminação de 2,5 dias em pacientes com função renal normal.
O cianeto tem como propriedade, uma elevada afinidade para os metais (daí a sua grande utilização na indústria de metais) formando com eles complexos. O cianeto absorvido vai formar complexos com catiões metálicos de centros activos de enzimas importantes, inibindo a sua função. O mecanismo que explica a toxicidade do cianeto envolve a inibição da cadeia respiratória mitocondrial. Este liga-se ao ferro no estado férrico (Fe3+) do citocromo oxidase mitocondrial (citocromo aa3), enzima que medeia a transferência de electrões para o oxigénio molecular, o último passo da fosforilação oxidativa. O bloqueio desta enzima interrompe, assim, a capacidade da célula usar o oxigénio, conduzindo a anoxia tecidular.Para além disso compromete o metabolismo da célula e a produção de ATP é drasticamente reduzida.
Esta incapacidade da célula para utilizar o oxigénio conduz ao aumento do metabolismo anaeróbio e ao rápido desenvolvimento de acidose láctea e hipóxia citotóxica. Uma vez que o cianeto não altera a capacidade da hemoglobina em transportar o oxigénio, uma quantidade suficiente de O2 é colocada à disposição dos tecidos mas este não pode ser utilizado. O sangue venoso é então oxigenado e adquire uma coloração tão vermelho vivo quanto o sangue arterial. A respiração é então estimulada pelas células quemorreceptoras como acontece quando a quantidade de oxigénio está diminuída. Inicialmente é observado um breve período de estimulação do CNS com hiperpneia e dor de cabeça, seguindo-se uma depressão que ocorre com hipóxia e morte por paragem respiratória.
Órgãos como o coração e o cérebro são particularmente afectados porque requerem muito ATP e têm uma capacidade limitada em suportar o seu défice. Uma vez interrompida a produção de ATP, o coração apenas é capaz de aguentar 3 minutos. Sendo assim, o cianeto pode causar morte por falha cardíaca ou respiratória.
O complexo ferro-cianeto é dissociável e rapidamente sofre ruptura tornando a desintoxicação possível através de mecanismos bioquímicos naturais, como já tinha sido referido, ou com terapia usando antídotos.
A ligação do cianeto a outros metais de enzimas catalíticas interfere com o metabolismo lipídico e do glicogénio, efeitos estes que são menos evidentes clinicamente em comparação com o dramático impacto do efeito do cianeto na respiração celular aeróbia.”
“Sintomatologia Clínica: A gravidade dos sintomas decorrentes do envenenamento por cianeto não está directamente ligada à fonte de cianeto que está na origem do acidente mas à quantidade e taxa de exposição a este composto.
O paciente pode aparecer com uma coloração rosada da pele uma vez que o sangue venoso apresenta uma cor tão vermelha quanto o sangue arterial. Isto acontece porque o cianeto bloqueia a utilização do oxigénio elevando a pressão parcial de oxigénio no sangue venoso.
Doses massivas de cianeto podem provocar, sem aviso, súbita perda de consciência e morte por paragem respiratória.
O cérebro é particularmente susceptível ao envenenamento por cianeto devido às suas elevadas exigências metabólicas. É observada uma diminuição da taxa celular de adenosina trifosfato e um aumento da taxa de adenosina difosfato por causa da predominância do metabolismo anaeróbio. A actividade eléctrica do cérebro é também alterada por ruptura dos neurotransmissores cálcio-dependentes, o que explica a manifestação dos efeitos neurotóxicos induzidos pelo cianeto, como tremores e convulsões.
“Tratamento e Antídotos após Envenenamento: O tratamento de envenenamento por cianetos deve ser rápido para ser eficaz. Baseia-se em monitorizar, estabelecer acesso intravenoso e administrar oxigénio a 100% por máscara a todos os pacientes com sugerida exposição a cianeto. A lavagem gástrica é indicada em pacientes com ingestão recente de cianeto, após o início de tratamento mais específico. O carvão activado liga-se a pequenas quantidades de cianeto e pode diminuir a gravidade de uma ingestão.
Embora muitos pacientes tenham sobrevivido a este tipo de envenenamento apenas com cuidados médicos, o uso de antídotos específicos tem salvado pacientes severamente envenenados.
Como a toxicidade resulta da ligação ao ferro na forma férrica do citocromo oxidase, o tratamento tem como objectivo a prevenção ou o reverter de tal ligação, através do fornecimento de uma larga reserva de ião férrico para competir pelo cianeto. Um mecanismo eficaz é administrar substâncias como o nitrato, que oxidam o ferro da hemoglobina a metemoglobina. O amil nitrito é habitualmente administrado por inalação, enquanto uma solução de nitrito de sódio é preparada para administração intravenosa. A metemoglobina formada compete com o citocromo oxidase pelo ião cianeto, estando esta reacção favorecida. Forma-se cianometemoglobina e o citocromo oxidase é restaurado.
O nitrito de sódio e o tiossulfato de sódio estão contidos no “Taylor Cyanide Antidote Kit”, utilizado nos Estados Unidos da América, e que também contém uma ampola de amil nitrito para inalação.
Devido à toxicidade do nitrito de sódio, um paciente assintomático nunca deve ser tratado com este. Os pacientes com exposição por inalação não requerem terapia com antídotos específicos se tiver ocorrido recuperação significativa antes de necessitarem de cuidados médicos.
A cápsula de amil nitrito é incluída como meio para iniciar a terapia quando o acesso intravenoso não foi obtido ou quando o tratamento é iniciado por pessoal não médico. Não é necessário administrar o amil nitrito se se pode usar o nitrito de sódio intravenoso.
Para o envenenamento sintomático por cianetos a dose de nitrito de sódio utilizada em adultos é de 300 mg, seguida de 12,5 g de tiossulfato de sódio. As crianças devem receber 0,33 ml/Kg de nitrito de sódio a 10% e 1,65 ml/Kg de tiossulfato de sódio a 25% (deve-se baixar a dose pediátrica de nitrito de sódio se houver história de anemia).
O maior efeito lateral da administração do nitrito é a hipotensão relacionada com os seus efeitos vasodilatadores. Metemoglobinemia como consequência da administração de nitritos ocorre mais frequentemente noutras espécies do que em humanos, apesar de ter ocorrido metemoglobinemia severa resultando na morte de uma criança, que recebeu nitrito de sódio por ingestão assintomática de cianeto.
O tiossulfato de sódio é dado a seguir à administração de nitrito de sódio, embora possa ser iniciado em simultâneo.
Os efeitos terapeûticos combinados destes dois agentes, como determinado pelo LD50 para os cianetos em estudos animais* são maiores que os seus efeitos aditivos demonstrando sinergismo.
O tiossulfato de sódio aumenta a taxa de desintoxicação do cianeto por doação de uma molécula de enxofre à enzima rodanase, que catalisa a formação de tiocianato menos tóxico, que é depois excretado na urina.
O uso somente de oxigénio tem apenas um ligeiro efeito de protecção neste tipo de envenenamento, no entanto, o oxigénio a 100% potencia dramaticamente os efeitos protectores do tiossulfato ou do nitrito/tiossulfato. Isto ocorre embora o cianeto bloqueie a utilização de oxigénio. Esta intensificação de eficácia está ainda por explicar, mas pode ser devida a tensões intracelulares elevadas de oxigénio suficientes para oxidação não enzimática dos citocromos reduzidos ou o oxigénio pode deslocar o cianeto de citocromo oxidase por acção de massas.
O uso de oxigénio em elevadas concentrações não parece trazer benefícios adicionais, excepto em pacientes com envenenamento por cianeto e por monóxido de carbono, em simultâneo.
*Way e associados (1972) demonstraram que o nitrito aumenta o LD50 do cianeto de potássio de 11 mg/Kg para 21 mg/Kg, em ratinhos; a administração de tiossulfato aumenta o valor para 35 mg/Kg, enquanto que o nitrito seguido de tiossulfato aumenta o LD50 para 52 mg/Kg.
No entanto a toxicidade dos nitritos levou à pesquisa de terapias eficazes mais seguras. Alternativamente pode-se usar 4-dimetilaminofenol intravenosamente numa dose de 3 mg/Kg, que também oxida a hemoglobina a metemoglobina (Weger,1983) e é usado na Alemanha.
Os compostos de cobalto têm uma afinidade para o cianeto (Way,1984)e o edetato dicobalto (Co2EDTA) é largamente usado para tratar este tipo de envenamento, no Reino Unido (Cottrell et al.,1978; Weger, 1983). Apesar de ser um antídoto eficaz, tem uma toxicidade significativa, especialmente quando o cianeto não está presente, limitando o seu uso como agente terapêutico empírico.
Analogamente a hidroxicobalamina (vitamina B12a) combina-se com o cianeto para formar cianocobalamina (vitamina B12) e tem sido usada para proteger pacientes sujeitos a infusões prolongadas de nitroprussiato de sódio. Quando a hidroxicobalamina é administrada sozinha, o cianeto é aprisionado na forma de cianocobalamina. No entanto, quando combinado com o tiossulfato de sódio, o cianeto aparece na forma de tiocianato. A administração concomitante do tiossulfato pensa-se reciclar a ligação hidroxicobalamina, reduzindo a quantidade de hidroxicobalamina necessária para desintoxicar uma determinada dose de cianeto.
Na prática, a maior parte destes agentes são usados em combinação com o tiossulfato de sódio”
“Exposição ambiental: O cianeto de hidrogénio pode surgir naturalmente como fonte de poluição ambiental produzido por microorganismos, bem como libertado aquando da degradação de glicosídeos cianogénicos (amigdalósidos, linamarósidos...). Muitos microorganismos fotossintéticos, como a alga verde-azul Anacystis nidulans produzem cianetos livres como resultado do metabolismo dos nitratos.
Como fonte artificial de poluição elegem-se o fumo do cigarro, as fornalhas usadas nas indústrias, locais de fabrico de gás para combustível e fornos de cozinha que geram gás cianídrico.
Quanto aos sais de cianeto, são os materiais contendo compostos de cianeto largados em terra que podem levar a níveis elevados de cianeto em águas subterrâneas e em estratos subjacentes.
A produção de ácido cianídrico e a sua utilização como matéria-prima no fabrico de acrilatos, sais de cianeto, herbicidas e tintas, assim como o seu uso em fumigantes, resulta na sua libertação para o ambiente. Se este é libertado para a atmosfera a uma pressão de vapor de 742 mm Hg a 25ºC indica que o ácido cianídrico irá existir unicamente como vapor na atmosfera. Este vapor de ácido cianídrico será degradado por reacções com radicais hidroxilo produzidos fotoquimicamente. O tempo de semi-vida para esta reacção no ar está estimado em 535 dias.
Se o cianeto de hidrogénio é libertado no solo espera-se uma grande mobilidade. A mobilidade dos cianetos é menor nos solos com baixo pH, alta concentração de óxidos de ferro livres e partículas carregadas positivamente. A mobilidade é maior a pH alto e elevada concentração de concentração de cálcio livre. A sua volatilização a partir de solos húmidos é um destino importante segundo a constante da lei de Henry (a solubilidade de um gás num líquido é proporcional à pressão do gás existente sobre a solução) de 1,33x10-4 atm-cu m/mol.
O ácido cianídrico poderá ainda volatilizar-se a partir da superfície de solos secos baseado na sua pressão de vapor.
Se o ácido cianídrico é libertado para a água, não é esperado que seja adsorvido a sólidos suspensos ou sedimentos devido à sua alta solubilidade na água. Pode ainda volatilizar-se a partir da superfície da água, que tem um tempo de semi-vida de 3 horas a nível de um rio e 3 dias no caso de um lago.
Valores experimentais sugerem que o potencial de bioacumulação em organismos aquáticos é baixo.
Os sais de sódio e potássio são muito solúveis na água e como resultado são rapidamente dissociados nos seus respectivos aniões e catiões uma vez libertados na água. O ião cianeto libertado pode depois formar ácido cianídrico ou reagir com outros metais presentes na água natural. Se o ião cianeto está presente em excesso, podem formar-se complexos cianometálicos, no entanto se os metais são prevalentes, são produzidos simples cianetos metálicos.
A exposição crónica ao ácido cianídrico pode ocorrer através de inalação e aos sais de cianeto por contacto dérmico com estes compostos no local de trabalho onde são produzidos ou usados: minas, indústrias de manuseamento e transformação de metais, indústria de plásticos,... A “American Conference of Governmental Industrial Hygienists” recomenda 5m/M de limite de exposição a curto prazo na pela para os cianetos de potássio e o cianeto de sódio. A OSHA recomenda limites de exposição médios de um dia normal de trabalho (8h) de 5m/M para os cianetos de potássio e sódio. Como os indivíduos que estão directamente ligados a estes locais estão mais vulneráveis a acidentes de envenenamento por este tóxico, medidas de segurança e prevenção no trabalho devem ser implementadas.
A população em geral pode estar exposta mais habitualmente ao ácido cianídrico a partir dos fumos dos automóveis e aos gases libertados pelas incineradoras e em particular os bombeiros e indivíduos expostos aos fumos da combustão de polímeros naturais e sintéticos (como os poliuretanos) durante fogos estruturais quando mobília e têxteis estão presentes.”
Formas de tratamento dos efluentes galvânicos cianídricos
As águas de lavagens de processos galvânicos que contém em suas formulações o íon cianeto, devido à sua toxidade e risco ambiental, necessitam de segregação e processos de tratamento para sua destruição com formação de lodos galvânicos específicos ou remoção dos cianetos e complexos cianídricos, em separado, permitindo inclusive seu reuso em circuito fechado.
Há três formas de classificação dos cianetos presentes nos efluentes:
- Cianetos totais – contém complexos metálicos com Fe - fortemente estáveis
- Cianetos de ácidos fracos dissociados – contém complexos metálicos fracos e moderados com Ag, Cd, Cu, Ni, Hg, Zn, Au.
- Cianetos livres – contém íons CN- e HCN
Na seqüência acima, 1 contém 2 e 3, e 2 contém 3.
Usualmente nas estações de tratamento de efluentes galvânicos, o cianeto é destruído em duas etapas de reações físico-químicas de oxidação pelo método da cloração alcalina. O processo utiliza cloro gasoso ou proveniente de hipocloritos de sódio ou cálcio. Na primeira fase de oxidação alcalina, em pH 12, cianeto é convertido a cianato, e posteriormente, em pH 8,0 cianato é convertido a gás carbônico, nitrogênio e amônia.
A concentração limite de segurança da reação é 2g/L de CN- presente no efluente, para evitar que pela reação exotérmica ocorra a volatilização do cloreto de cianogênio (CNCl) mortal se inalado pelo homem caso esteja presente em concentração superior a 0,4g/m3 de ar.
O processo de cloração alcalina é bastante eficiente na destruição de cianetos, utiliza grandes massas de cloro na forma de hipoclorito de sódio (NaClO) ou Cálcio (Ca (ClO)2), resultando em custo elevado devido as grandes massas de reagentes utilizadas e lodos resultantes.
Em geral, são necessários teóricos 2,73g de Cl2 para cada grama de CN- oxidada a CNO-. Na prática, há uma variação chegando até a 8g de Cl2 para a reação completa de destruição do cianeto, pois há etapas intermediárias de oxidação da amônia formada nas reações.
Outros processos de destruição via oxidação de cianeto não usuais nas instalações galvânicas, que são encontrados em vários segmentos industriais, principalmente no setor de mineração, são:
- INCO – Dióxido de Enxofre / Ar – Desenvolvido nos idos dos anos 1980, por INCO Limited, este processo utiliza SO2 e Ar na presença de um catalisador de cobre (10 a 50 mg/L de cobre) para oxidar cianeto, em pH 8,0 a 9,0. Em teoria são necessários 2,46 gramas SO2 por grama de cianeto oxidado, mas na prática isso varia de 3,5 e 4,5 gramas de SO2 /g CN-. Há mais de trinta instalações ao redor do planeta onde o processo foi implantado. A presença do enxofre neste processo facilita a formação de precipitados metálicos altamente estáveis devido ao pequeno produto de solubilidade da maioria dos sulfetos.
- Peróxido de Hidrogênio – Trata-se de um processo semelhante ao Dióxido de Enxofre /Ar, onde o peróxido de hidrogênio substitui os dois componentes anteriores para oxidar cianeto. Da mesma maneira que no processo anterior, as reações ocorrem na presença de cobre como catalisador em pH 9,5 a 10,5. Metais pesados como cobre, níquel e zinco são facilmente precipitados neste processo. Quando há complexos de ferrocianetos presentes, numa segunda etapa é necessário reduzir um pouco o pH para completar a reação de precipitação, ao redor de pH 6,0. Em teoria são necessários 1,31 gramas de H2O2 50% (200Vol) para oxidar 1 grama de cianeto. Na prática isso varia de 2 a 8 gramas de Peróxido de Hidrogênio para 1g de cianeto. Este processo tem boa aplicabilidade para tratar níveis baixos de concentração de cianetos.
- Ácido de Caro – Utiliza o Ácido Peroximonosulfúrico, H2SO5, e sua aplicação foi recentemente desenvolvida para o tratamento de efluentes contendo cianetos. Devido à rápida decomposição do ácido de caro, este é produzido in situ durante a reação com o efluente, a partir do ácido sulfúrico (2 a 2,5 moles) e do peróxido de hidrogênio (1 mol). O pH situa-se acima de 9,0 e a temperatura varia numa faixa de 0 a 80°C. Sua aplicação é interessante quando o catalisador cobre não pode estar presente. Também este processo apresenta vantagens para tratamento de cianetos presentes em lodos, ao invés de soluções. O consumo teórico de H2SO5 é 4,39 gramas por grama de cianeto oxidado, entretanto na prática o consumo varia de 5,0 a 15,0 gramas do ácido de caro por grama de cianeto oxidado. O ácido excedente produzido na reação é neutralizado com cal.
- Bio-oxidação – Diversas espécies de plantas, algas, fungos, bactérias aeróbicas e anaeróbicas e leveduras em combinação com enzimas e aminoácidos promovem metabolicamente a oxidação natural de cianetos a cianatos. Amônia ocorre livre como resultado da maioria das reações com a biomassa e necessita remediação posterior. Em geral as reações ocorrem em pH 7, temperatura ambiente, com mecanismos de absorção, adsorção e precipitação. O processo de bio-oxidação patenteado mais conhecido para remediação de cianeto livre, cianocomplexos e tiocianatos utiliza um biofilme composto principalmente da bactéria pseudomona paucimobilis, operando em um reator biológico rotativo com a vantagem de não produzir amônia como subproduto.
- Ozonização – A oxidação de cianeto utilizando gás ozônio é uma prática que substitui com vantagens a cloração alcalina e promove a destruição de complexos e precipitação de óxidos de metais pesados presentes. O gás ozônio é gerado in situ no reator que contém o efluente a ser tratado. A produção de O3 pode ocorrer através do gás O2, ou através do ar, dependendo do tipo de equipamento utilizado. As reações ocorrem em pH 10, e para cada grama de cianeto totalmente oxidado necessita-se de 4 a 8 gramas de O3. O consumo energético depende do tipo de gerador de O3 utilizado, variando de 8 a 20KWh por Kg de Ozônio produzido. Se houver compostos orgânicos halogenados presentes no efluente a ser tratado, o sistema de gás ozônio pode ser combinado com radiação ultravioleta para a destruição dos compostos indesejáveis.
- Eletro-Oxidação / Remoção – Processo similar à eletrodeposição metálica, onde o efluente contendo cianetos metálicos é eletrolisado em reator eletroquímico aberto ou fechado utilizando-se eletrodos bidimensionais e tridimensionais, dimensionalmente estáveis, por exemplo cátodo de carbono vítreo reticulado e anodo de titânio revestido com rutênio. As variáveis do processo são geralmente a concentração dos cianetos metálicos, pH, temperatura, resistividade, velocidade de fluxo do efluente, tensão e corrente elétrica. Neste processo, cianetos são destruídos por oxidação pela liberação de O2 no anodo e metais presentes são reduzidos e depositados no cátodo.
- Fotólise –Ultravioleta/H2O2 - Processo Oxidativo Avançado de cianetos que utiliza um reator contendo lâmpada ultravioleta, que devido a alta absorção de raios UV pelo peróxido de hidrogênio com sua posterior dissociação forma radicais •OH, altamente reativos e depois reage com os ciano complexos por fotólise direta. Os sistemas podem operar em regime de fluxo contínuo ou bateladas e o desenho do reator depende de muitas variáveis determinadas a partir da caracterização físico-química do efluente. Para o cianeto o sistema opera com pH acima de 8,0, longo tempo de exposição, baixa taxa de fluxo, com bom rendimento final. O fator impeditivo desse tipo de reator é a curta vida útil das lâmpadas de ultravioleta e seu custo elevado.
Os principais processos de separação de cianeto são enumerados a seguir:
- Eletrodiálise – Utiliza um reator eletroquímico que possui eletrodos bidimensionais e tridimensionais dimensionalmente estáveis e através do correto dimensionamento do transporte de massa em meios fluidos o processo possibilita aos cátions permearem membranas catiônicas migrando e concentrando-se em seus respectivos católitos ou reduzindo metais nos respectivos cátodos, e ânions permearem membranas aniônicas migrando e concentrando seus respectivos anólitos ou oxidando ânions nos respectivos anodos. Variáveis como pH, pressão, temperatura, tensão, corrente elétrica, vazão, massa, condutividade, resistividade, são fundamentais ao estudo para estabelecimento correto de cada aplicação. No caso específico de efluentes contendo cianetos metálicos e cianetos livres, os metais são reduzidos nos cátodos, os cianetos complexados oxidados no anólito, e cianeto livre pode ser recuperado através de sua concentração no respectivo católito.
- Osmose Reversa – O processo de osmose reversa para separação e/ou recuperação de cianetos metálicos (especialmente zinco, cobre, prata e ouro) utiliza uma membrana impermeável aos cianetos, de curta vida útil, resultando em rejeitos com baixa concentração de cianetos e baixo rendimento na recuperação de água. O rejeito contendo os cianetos metálicos necessita de alguma técnica de concentração para reuso ou pode ser tratado por outro método de destruição de cianetos para recuperação de metais.
- Eletrocoagulação / flotação – Uma das mais antigas técnicas, remonta o século XIX, a célula de eletrocoagulação / flotação consiste em um reator eletroquímico aberto composto de múltiplos eletrodos bidimensionais, normalmente anodos de ferro (outros metais podem ser usados como fonte de íons ao meio) e cátodos de aço inox (ou outro material dimensionalmente estável), dispostos em lamelas com pequena distância entre os eletrodos em torno de 30mm. O efluente é percolado de baixo para cima com tempo de residência mínimo de 30 minutos, eletrolisado durante sua subida sob uma tensão elétrica de cerca de 0,9VDC por litro de efluente. O anodo de ferro é consumido liberando íons ao meio e formando complexos cianídricos insolúveis. Durante as reações ocorrem os fenômenos físicos de coagulação e flotação e os produtos dessas reações podem ser recuperados, depois de separados do meio líquido. O rendimento das células depende de fatores como pH, corrente elétrica, tensão elétrica, velocidade de fluxo do efluente e composição do efluente.
- Hidrólise / Destilação - Cianeto livre naturalmente hidrolisa em presença de água e produz o ácido cianídrico em solução, com posterior volatilização do referido gás. O fenômeno ocorre devido a diferenças de pressão de vapor do HCN(g), 100KPa a 26°C, com ponto de ebulição em 25,6°C, em detrimento da água que tem pressão de vapor em 34KPa a 26°C, com ponto de ebulição em 100°C. Isso facilita a separação do HCN(g) em temperaturas relativamente altas ou pressões relativamente baixas. Em sistemas de destilação desse tipo de efluente, o HCN(g) pode ser capturado e concentrado em torres lavadoras de gases projetadas com a devida segurança para este tipo de gás. Tiocianatos e complexos cianídricos solúveis não são removidos na destilação, requerendo posterior tratamento em outra técnica.
- AVR (Acidificação-Volatilização-Recuperação) – Este processo utiliza equipamentos que requer extrema segurança operacional e consiste em acidificar a solução contendo cianetos em pH na faixa 1,5 a 2 com ácido sulfúrico, coletar o cianeto de hidrogênio desprendido em uma torre lavadora do gás onde o mesmo poderá ser recuperado em um meio alcalino. O efluente inicial após a remoção do cianeto livre é neutralizado com cal e metais pesados presentes no mesmo são precipitados. Trata-se de um dos processos que mesmo considerando os requisitos de segurança pode oferecer em caso de acidente, maior risco à vida humana e ao meio ambiente.
- Adição de metal (cementação) – Desenvolvido no século XIX, este é um processo clássico de recuperação de ouro das soluções cianídricas pela adição de zinco metálico em pó. Há troca e substituição do metal zinco entre o cianeto de ouro, ocorrendo posteriormente à redução do ouro em sua forma metálica. Outros metais podem ser usados em substituição ao zinco, resultando em diferentes velocidades de reação. Durante décadas este processo liderou como principal meio de separação de ouro metálico, embora ele não seja ideal para soluções cianídricas de baixo teor metálico, causando perdas no rendimento do processo.
- Complexação com Fe – (Ferri e Ferro-cianeto) – Usa o Sulfato Ferroso Heptahidratado, (FeSO4.7H2O) para fornecer os íons metálicos para formação de complexos insolúveis e solúveis (de menor toxidade ao meio), tais como: Hexacianoferrato (III) (Fe(CN)6-3), Azul da Prússia (Fe4[Fe(CN)6]3), e outros complexos insolúveis resultado de combinações metálicas com ferro, MxFey(CN)6. O processo é conduzido em pH na faixa 5,0 a 6,0, com adição do (FeSO4.7H2O) entre 0,5 e 5,0 moles de Fe por mol de CN-. Este processo tem limitações quando se deseja precipitação controlada com a finalidade de remoção de algum componente específico do meio.
- Flotação e Precipitação – Processo introduzido no século XIX, inicialmente para separação de metais em mineração, posteriormente adaptado para tratamento de efluentes cianídricos, utiliza diversos reagentes com a finalidade de formar precipitados e colóides que após a injeção de microbolhas de ar, finalizam a separação de fases, permitindo assim remediação do efluente.
- Íon Flotação – Usa um reagente orgânico, um surfactante heteropolar, usualmente uma amina catiônica como cloreto de tricaprymethyl amônio (R4NCl) adicionada ao efluente cianídrico para reagir com os ânions do complexo, com a finalidade de precipitar um sal duplo orgânico que após sua nucleação formará colóides ou partículas grandes. Injeção de microbolha de ar finalizam o processo de separação. Os processos de flotação/precipitação descritos acima (itens 15 e 16) tem limitações de aplicação, complexos cianídricos fracos e moderados, juntamente com tiocianatos resultam em baixo rendimento neste tipo de remediação.
- Extração com solvente – A técnica desenvolvida na metade do século XX teve sua principal aplicação na extração seletiva de cianeto de ouro usando como solvente de extração ésteres de amina e fósforo. Devido ao alto custo de solventes e várias etapas do processo, sua aplicação em efluentes cianídricos diluídos é rara.
- Adsorção mineral – Alguns minerais como a ilmenita (FeTiO3), hematita (Fe2O3), bauxita [AlOOH/Al (OH)3] e a pirita (FeS2), juntamente com feldspatos, argilas e zeólitas tem propriedades de adsorção livre de complexos cianídricos metálicos. Os mecanismos envolvidos são troca iônica, precipitação ou interação coulombica. A técnica originariamente utilizada apenas em mineração na purificação de águas superficiais e subterrâneas, pode ser adaptada para remediação de efluentes cianídricos, operando em bateladas ou regime contínuo em colunas.
- Carvão ativado – Usado desde o antigo Egito e Índia, os tipos de carvões ativados usados para adsorver cátions e ânions são originários de madeira, turfa, coco e conchas, preparados por processos termoquímicos. Devido a alta porosidade e superfície do carvão ativado e afinidade por adsorver, através de mecanismos de troca iônica, solvatação, agentes quelantes e interações coulombicas, estes se prestam ao trabalho de retenção também de cianetos complexados, embora o rendimento seja baixo, aplicável apenas a efluentes com pouco resíduos a remediar. O melhor rendimento está nos equipamentos com leitos em colunas. Os carvões para esta aplicação não possibilitam regeneração.
- Resina de troca iônica – A tecnologia de troca iônica foi desenvolvida há 65 anos (Rohm and Haas) atualmente oferece grande diversidade de resinas de troca iônica que são copolímeros sintéticos insolúveis, sólidos ou líquidos, que possuem sítios ativos com afinidade a cátions ou ânions, desenvolvidos especialmente para aplicações específicas e são utilizadas principalmente para modificar as características das substâncias presentes em um meio fluído ao ser percolado através de um reator de colunas contendo resinas de características ácidas ou básicas. Especialmente para efluentes cianídricos foram patenteadas diversas aplicações para diferentes resinas que permitem remover, recuperar e reutilizar cianetos, metais e água em suas várias formas. Os processos são simples, seguros e resultam em alto rendimento e baixo custo operacional. Ao contrário do que ocorre em outros países industrializados, no Brasil são poucas as aplicações de resinas de troca iônica no campo da galvanotécnica.
Conclusões
Embora haja intenção e esforços mundiais para reduzir ao máximo o uso de cianetos, desejo tímido visto pela ótica comercial, é consenso dos organismos ambientais, associações industriais, centros de pesquisa e governos que seu uso racional e controlado ainda será necessário por longo período, devido a sua diversidade e importância das aplicações.
Considerando as várias possibilidades existentes demonstradas neste trabalho, dentre as principais técnicas de remoção de cianetos metálicos destacamos as tecnologias modernas e inovadoras de troca iônica, a eletrodiálise e as resinas sintéticas, sendo que a tecnologia de resinas de troca iônica é mais segura, simples de operar, requer menor investimento inicial e que resulta ao cliente na melhor relação custo-benefício com recuperação de água de processo e cianetos metálicos.
Bibliografia consultada
-ASCENÇÃO, J.G.; NEVES, A.I.P.; REMIÃO,F. Cianeto: Toxicologia e Fisiopatologia, Laboratório de Toxicologia da Faculdade de Farmácia da Universidade do Porto, Portugal, http://www.ff.up.pt/toxicologia/monografias/ano0304/Cianetos/index.htm,
acesso em 21/11/2007.
-BERGERON et all. – Rohm and Haas Company, Process for Producing Hidrogen Cyanide, United State Patent n° US7063827, Jun,20,2006, Philadelphia, PA, US
-BERTAZZOLI, R; LANZA, M.R.V. Selection of a Commercial Anode Oxide Coating for Electro-oxidation of Cyanide. J. Braz. Chem. Soc., Vol. 13, No. 3, 345-351, 2002.
-BONAN, A. – Estudo cinético da oxidação de cianetos em efluentes com peróxido de hidrogênio, dissertação de mestrado, PUC-Rio, Rio de Janeiro, 1992.
-BOTZ, M.M.; MUDDER, T.I., “Modeling of Natural Cyanide Attenuation in Tailings Impoundments”, Minerals and Metallurgical Processing, Vol. 17, No. 4, pp. 228-233,
November 2000.
-S.B. TUWINER, Investigation of Treating Electroplaters Cyanide Waste by Electrodialysis, U.S. EPA Report No. EPA/R2/73-287, 1973.
-YOUNG C.A; JORDAN, T.S. Cyanide Remediation: Current And Past Technologies, Department of Metallurgical Engineering, Montana Tech,Butte, MT 59701.
Nota dos autores
Devido ao grande número de reações químicas envolvidas nas técnicas citadas neste trabalho, foram suprimidas do mesmo por razões de espaço físico na publicação.












