BANHO DE NÍQUEL TIPO WATTS
PARTE VII - A utilização de cestos de titânio nos processos de niquelação

Leia as partes anteriores
Parte 1 - https://www.portalts.com.br/banho-de-niquel-tipo-watts
Parte 2 - https://www.portalts.com.br/banho-de-niquel-tipo-watts-parte-2
Parte 3 - https://www.portalts.com.br/banho-de-niquel-tipo-watts-parte-3
Parte 4 - https://www.portalts.com.br/banho-de-niquel-tipo-watts-parte-4
Parte 5 - https://www.portalts.com.br/banho-de-niquel-tipo-watts-parte-5
Parte 6 - https://www.portalts.com.br/banho-de-niquel-tipo-watts-parte-6
O presente trabalho é uma republicação (o original foi publicado nesta mesma revista em v.17, n. 80, p. 22-24, nov./dez. 1996). Trata-se de ampla revisão bibliográfica realizada com o objetivo de abordar os vários aspectos envolvidos nos banhos de níquel tipo Watts. Ele será publicado na forma de vários artigos cada qual tratando de um aspecto específico. Esta sétima parte tratará dos cestos de titânio usados para acomodação dos anodos de níquel.
1. CESTOS DE TITÂNIO PARA ANODOS DE NÍQUEL
Nos processos de niquelação, nos quais se utilizam anodos em forma de pastilhas de níquel, o acondicionamento das pastilhas é feito em cestos. Tais cestos devem ser confeccionados de material resistente ao banho de níquel. O material mais adequado para esta finalidade é o titânio, por ser um metal que se mantém passivo na maioria dos banhos comerciais de níquel, incluindo aqueles com altos teores de cloreto. O único tipo de banho que é agressivo ao titânio é o de fluoboratos, visto que o titânio é prontamente atacado pelo íon fluoreto.
Cestos de outros materiais, como por exemplo, cestos de aço inoxidável revestido com material plástico podem ser utilizados. Nesses casos, o contato elétrico deve ser feito diretamente com os anodos. No caso de se utilizar cestos de titânio, o contato elétrico pode ser feito via cesto, por meio de garras de titânio.
2. GARRAS PARA CONTATO ELÉTRICO E GANCHEIRAS DE TITÂNIO
Nos banhos de níquel, excluindo aqueles de fluoboratos, é recomendável a utilização de garras e gancheiras de titânio, devido à alta resistência à corrosão deste metal quando em contato com banhos de níquel.
A vantagem é que as garras ou gancheiras podem estar imersas ou emersas, sem haver perigo de contaminação do banho com os produtos de corrosão do titânio. No caso de se utilizar garras de cobre, ter-se-ia grande possibilidade de contaminação dos banhos de níquel, principalmente em condições de imersão parcial, pois os produtos de corrosão formados sobre o cobre, nestas condições, não são muito aderentes e sofrem destacamento contaminando o banho.
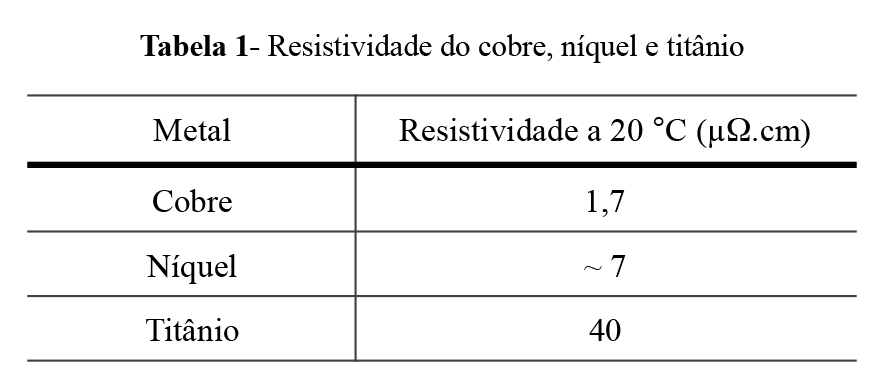
O cuidado que se deve tomar ao se utilizar garras para contato elétrico de titânio é a adoção de garras mais grossas, para garantir maior superfície de contato. Isto porque o titânio apresenta resistividade elétrica superior à do cobre, e ao próprio níquel, conforme é mostrada na Tabela 1.
Tabela 1- Resistividade do cobre, níquel e titânio
Como o titânio mantém-se passivo nos banhos de níquel, poder-se-ia levantar a seguinte questão: a camada de óxido de titânio formado sobre o metal não interfere na passagem da corrente elétrica no local do contato elétrico?
Para entender este fato e responder à questão feita, deve-se citar o fato de que o óxido de titânio apresenta resistência mecânica muito baixa, de modo que somente o peso das pastilhas e/ou a pressão entre metais já é capaz de rompê-la e ocasionar a passagem da corrente elétrica.
3. COMPORTAMENTO DO TITÂNIO NOS BANHOS DE NÍQUEL
A alta resistência à corrosão do titânio na maioria dos banhos de níquel é devido à passivação, ou seja, à formação de uma camada coerente, uniforme e compacta de óxidos sobre a superfície do titânio.
A camada de óxidos que se forma sobre a maioria dos metais, incluindo o níquel e o titânio, pode, em condições propícias, sofrer danificação localizada o que determina a corrosão por pite destes metais.
A susceptibilidade à corrosão por pite dos metais depende da natureza do meio e do potencial da interface metal/meio. Para um determinado sistema metal/meio susceptível à corrosão por pite, a danificação localizada ocorre acima de um certo potencial crítico (potencial de pite) característico de cada metal.
No caso do sistema níquel/banho, o potencial de pite é menor do que o potencial de equilíbrio da reação de formação do gás oxigênio (que é da ordem de 1,23 V, em relação ao eletrodo padrão de hidrogênio), de modo que anodos de níquel funcionam perfeitamente como anodos solúveis nos banhos cloretados.
A camada de óxidos que se forma sobre o titânio é muito mais resistente do que aquela que se forma sobre o níquel, sofrendo corrosão por pite somente a potenciais muito maiores do que o potencial de equilíbrio da reação de formação do gás oxigênio. Para se ter uma ideia, em banhos de só cloretos essa corrosão ocorre quando o potencial da interface titânio/banho alcança valores de 10 V a 14 V medido em relação ao eletrodo padrão de hidrogênio.
A adição de íons sulfatos nos banhos de só cloretos dificulta drasticamente a corrosão por pite do titânio, podendo inclusive impedi-la. A quantidade mínima de sulfatos capaz de impedir a danificação localizada da camada de óxido de titânio para a ocorrência da corrosão por pite, depende do pH do banho. Para valores de pH da ordem de 4, uma relação entre os íons de sulfato e cloreto superior a 0,25 já é suficiente para que não se verifique a corrosão por pite do titânio. No caso dos banhos de níquel tipo Watts (300 g/L de sulfato de níquel e 60 g/L de cloreto de níquel), a relação sulfato/cloreto é da ordem de 6, o que significa que o titânio não sofre corrosão do tipo pite quando imerso num banho tipo Watts.
Nas condições em que o titânio não sofre corrosão por pite, a quebra da camada de óxidos não será mais localizada mas sim generalizada, ocorrendo para valores de potenciais na interface titânio/banho acima de 50 V medidos em relação ao eletrodo de hidrogênio.
Conclui-se, assim, que os cestos de titânio utilizados nos banhos de níquel tipo Watts não deverão corroer nas condições operacionais normais, visto que é praticamente impossível alcançar valores da ordem de 50 V na interface cesto de titânio/banho.
Os problemas que podem surgir quando o potencial da interface titânio/banho aumentar de maneira excessiva é a formação de gás cloro. Isto ocorrerá quando o potencial da interface titânio/banho ultrapassar o valor do potencial de equilíbrio da reação:
Cl2 + 2e- ? 2 Cl-
No caso de um banho de níquel tipo Watts com 60 g/L de cloreto de níquel, este potencial é da ordem de 1,35 V (em relação ao eletrodo padrão de hidrogênio). Assim, quando se ultrapassar esse valor, poderá haver a formação de gás cloro. Convém lembrar, que o mesmo perigo existe na superfície dos anodos de níquel passivados.
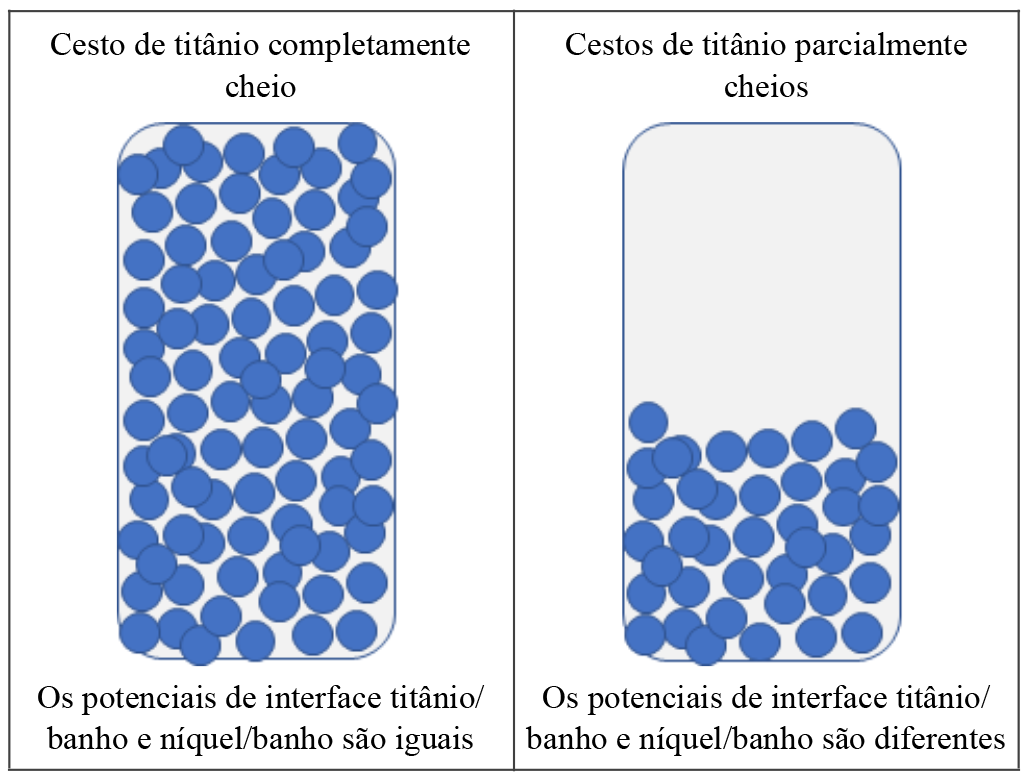
Resta saber em que condições pode ocorrer a subida do potencial na interface titânio/banho. Quando os cestos estão completamente cheios com as pastilhas de níquel, os potenciais da interface titânio/banho e níquel/banho são iguais e muito próximos ao potencial da interface níquel/banho, que em condições adequadas de operação é um valor abaixo do potencial de equilíbrio da reação de formação do gás oxigênio (1,23 V, em relação ao eletrodo padrão de hidrogênio). Nessas condições, nada ocorrerá. Se, no entanto, os cestos estiverem parcialmente cheios, nos locais onde não tem anodos de níquel, o potencial da interface titânio/banho aumentará podendo ultrapassar o valor do potencial de equilíbrio do oxigênio ou do cloro. Nestas condições, poderá haver liberação de gás oxigênio e liberação de gás cloro, respectivamente. A Figura 1 ilustra este fato.
|
Figura 1 - Ilustração esquemática de cestos de titânio completa e parcialmente cheios com anodos de níquel |
3. RAZÃO DO LIMITE DE 10 V PARA A DIFERENÇA DE POTENCIAL DE CÉLULA (VOLTAGEM), ESTABELECIDA PARA ALGUNS PROCESSOS DE NÍQUEL
Antes de discutir este assunto, é de fundamental importância que os conceitos de potencial de eletrodo e potencial de célula (voltagem) sejam compreendidos.
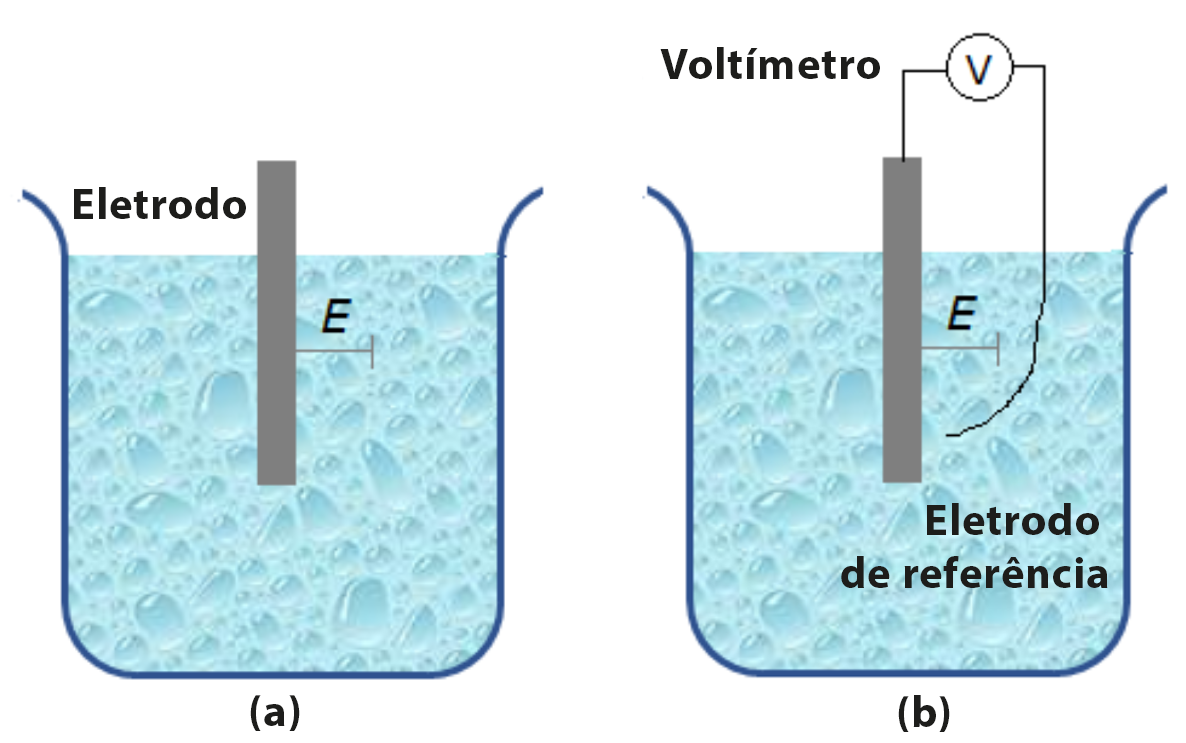
Para tal, considere um metal mergulhado num eletrólito mostrado na Figura 2a. Dá-se o nome de eletrodo ao sistema metal/eletrólito. O eletrodo é caracterizado por apresentar uma diferença de potencial, E, na interface conforme ilustrado na Figura 2a. A essa diferença de potencial dá-se o nome de potencial de eletrodo. Para medir o valor desse potencial, mergulha-se no eletrólito um eletrodo de referência e conecta-se ao eletrodo, objeto de medida, através de um voltímetro, conforme ilustra a Figura 2b.
|
Figura 2 – Um metal mergulhado num eletrólito é um eletrodo (a). Medida do potencial do eletrodo utilizando um eletrodo de referência e um multímetro de alta resistência interna (b). |
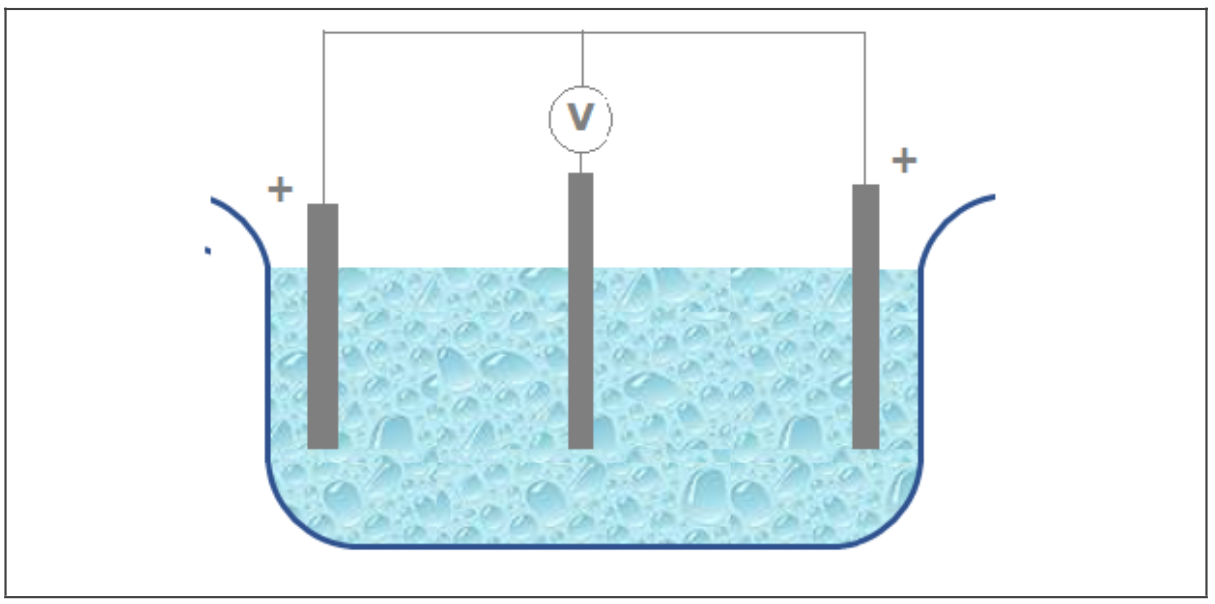
Nas indústrias de eletrodeposição não é comum medir o potencial de eletrodo. Em geral, esse tipo de medida é feito por pesquisadores preocupados com estudos fundamentais de eletrodeposição. Na prática, o que se mede é a diferença de potencial entre os anodos e o catodo, conforme ilustrado na Figura 3
|
|
|
Figura 3 - Ilustração esquemática da medida da diferença de potencial entre os anodos e o catodo de uma célula de eletrodeposição. |
Note que, nesse caso, tem-se três eletrodos, dois anodos (em curto circuito) e o catodo. Na prática, a esta diferença de potencial dá-se o nome de potencial de célula ou simplesmente voltagem, sendo um valor medido pelos retificadores utilizados nas indústrias de eletrodeposição.
É comum, em algumas especificações de processos de eletrodeposição, restringir-se a voltagem estabelecendo-se um valor máximo de 10 V. Esta restrição só é válida para banhos de só cloretos e não se refere à VOLTAGEM mas sim ao potencial de eletrodo.
O potencial de célula ou voltagem depende da geometria da célula, da distância anodo/catodo, da condutividade do banho (e portanto da temperatura) não se podendo estabelecer limites com base em especificações do fornecedor de produtos químicos. Assim, é fácil entender que os limites estabelecidos se referem ao potencial da interface anodo/banho, ou seja o potencial de eletrodo, que devem ser medidos com eletrodos de referência. Tais medidas não são comumente realizadas nas indústrias de eletrodeposição, conforme já mencionado.
É evidente que se for adotado como limite máximo de VOLTAGEM o valor de 10 V, ter-se-á na interface anodo/banho um valor de potencial de eletrodo inferior a 10 V.
Caso o banho utilizado seja só de cloretos, a adoção do limite de VOLTAGEM oferece garantia irrefutável de não corrosão dos anodos de titânio. No entanto, no casos nos quais não há perigo de corrosão localizada dos cestos de titânio (como nos banhos tipo Watts que têm altos teores de sulfatos), não se justifica a adoção de um limite para a VOLTAGEM.
A restrição deveria ser dirigida ao fato de se evitar cestos parcialmente cheios para não se ter possibilidade de evolução de gases (cloro e oxigênio), mesmo em condições adequadas de operação em que se tem a perfeita dissolução dos anodos de níquel.